 |
 |

PAGES DU PRATICIEN
Effets bénéfiques et risques du contrôle strict de la glycémie chez le patient adulte en état critiqueUne méta-analyse
Renda Soylemez Wiener, MD, MPH;
Daniel C. Wiener, MD;
Robin J. Larson, MD, MPH
JAMA. 2008;300(8):933-944
RÉSUMÉ
 |  |
Contexte L’American Diabetes Association et la Surviving Sepsis Campaign recommandent un contrôle strict de la glycémie chez le patient en état critique, en se fondant largement sur un essai ayant montré une réduction de la mortalité dans une unité de soins intensifs chirurgicaux. Des résultats différents ayant été observés dans des études similaires et un contrôle strict de la glycémie pouvant entraîner une hypoglycémie dangereuse, une évaluation critique des données qui sous-tendent cette recommandation est nécessaire.
Objectif Évaluer les effets bénéfiques et les risques du contrôle strict de la glycémie par rapport aux soins habituels chez le patient adulte en état critique.
Sources des données MEDLINE (de 1950 à 2008), la Cochrane Library, les registres d’essais cliniques, les listes bibliographiques et les actes de conférences de l’American Thoracic Society (de 2001 à 2008) et de la Society of Critical Care Medicine (de 2004à 2008).
Sélection des études Nous avons recherché les études dans lesquelles des patients adultes de soins intensifs étaient répartis de façon aléatoire en plusieurs groupes, certains bénéficiant d'un contrôle strict de la glycémie et d’autres d'un contrôle glycémique habituel, sans restriction de langue. Sur les 1 358 études identifiées, 34 essais randomisés (23 publications complètes, neuf résumés et deux études non publiées) remplissaient les critères d’inclusion.
Extraction et analyse des données Deux auteurs ont extrait les données indépendamment en utilisant un protocole prédéterminé et évalué la qualité méthodologique à partir d'une échelle normalisée. Les investigateurs des études ont été contactés afin d’obtenir certaines informations manquantes. Nous avons utilisé des modèles à effets fixes et aléatoires pour estimer les risques relatifs (RR).
Résultats 29 essais comparatifs randomisés portant sur 8 432 patients au total ont été inclus dans cette méta-analyse. Dans l'ensemble aucune différence n’a été observée en termes de mortalité hospitalière entre les patients ayant bénéficié d'un contrôle strict de la glycémie et ceux ayant reçu les soins habituels (21,6 % contre 23,3 % ; RR = 0,93 [intervalle de confiance (IC) 95 : 0,85-1,03]). Aucune différence significative en termes de mortalité n'a été mise en évidence en cas de stratification en fonction de la cible glycémique ([1] très stricte : 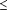 110 mg/dL : 23 % contre 25,2 % ; RR = 0,90 [IC95 : 0,77-1,04], ou [2] modérément stricte : < 150 mg/dL ; 17,3 % contre 18,0 % ; RR = 0,99 [IC95 : 0,83-1,18]) ou en fonction du type de l’unité de soins intensifs ([1] chirurgicaux : 8,8 % contre 10,8 % ; RR = 0,88 [IC95 : 0,63-1,22] ; [2] médicaux : 26,9 % contre 29,7 % ; RR = 0,92 [IC95 : 0,82-1,04] ; ou [3] médico-chirurgicaux : 26,1% contre 27,0% ; RR = 0,95 [IC95 : 0,80-1,13]. Un contrôle strict de la glycémie n'a pas été associé à une réduction significative du risque de nouveau besoin de dialyse (11,2 % contre 12,1 % ; RR = 0,96 [IC95 : 0,76-1,20]), mais a été associé à une réduction significative du risque de septicémie (10,9 % contre 13,4 % ; RR = 0,76 [IC95 : 0,59-0,97] ; et à une augmentation significative du risque d'hypoglycémie (glucose 110 mg/dL : 23 % contre 25,2 % ; RR = 0,90 [IC95 : 0,77-1,04], ou [2] modérément stricte : < 150 mg/dL ; 17,3 % contre 18,0 % ; RR = 0,99 [IC95 : 0,83-1,18]) ou en fonction du type de l’unité de soins intensifs ([1] chirurgicaux : 8,8 % contre 10,8 % ; RR = 0,88 [IC95 : 0,63-1,22] ; [2] médicaux : 26,9 % contre 29,7 % ; RR = 0,92 [IC95 : 0,82-1,04] ; ou [3] médico-chirurgicaux : 26,1% contre 27,0% ; RR = 0,95 [IC95 : 0,80-1,13]. Un contrôle strict de la glycémie n'a pas été associé à une réduction significative du risque de nouveau besoin de dialyse (11,2 % contre 12,1 % ; RR = 0,96 [IC95 : 0,76-1,20]), mais a été associé à une réduction significative du risque de septicémie (10,9 % contre 13,4 % ; RR = 0,76 [IC95 : 0,59-0,97] ; et à une augmentation significative du risque d'hypoglycémie (glucose 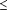 40 mg/dL ; 13,7 % contre 2,5 % ; RR = 5,13 [IC95 : 4,09-6,43]). 40 mg/dL ; 13,7 % contre 2,5 % ; RR = 5,13 [IC95 : 4,09-6,43]).
Conclusion Chez le patient adulte en état critique, un contrôle strict de la glycémie n’est pas associé à une réduction significative de la mortalité hospitalière mais est associé à une augmentation du risque d'hypoglycémie.
En 2001, Van den Berghe et al.1 ont publié un essai comparatif randomisé portant sur des patients chirurgicaux en état critique qui faisait état d'une réduction d'un tiers de la mortalité hospitalière en cas de contrôle strict de la glycémie. La réduction la plus forte ayant été observée dans le sous-groupe de patients présentant une septicémie et une défaillance multiviscérale, certains ont soulevé l’hypothèse que les effets bénéfiques d’un contrôle strict de la glycémie pourraient également s’appliquer aux patients en unité de soins intensifs (USI) médicaux.2
Chez le patient adulte en état critique, rares sont les interventions entraînant une telle réduction de la mortalité, c'est pourquoi les résultats de cet essai ont été accueillis avec enthousiasme et rapidement intégrés dans les directives. En 2004, la Surviving Sepsis Campaign3 recommandait un contrôle glycémique chez tous les patients atteints d'une septicémie et affirmait explicitement qu'il « n'y [avait] aucune raison de penser que ces données ne sont pas généralisables à tous les patients atteints d'une septicémie sévère. » Cette recommandation figure toujours dans la mise à jour de 2008 et a été adoptée à l'échelle internationale par 16 associations professionnelles.4En outre, l’Institute for Healthcare Improvement5, la Volunteer Hospital Association6, la Michigan Health and Safety Coalition7, l’American Association of Clinical Endocrinologists8, et l’American Diabetes Association9 recommandent à présent un contrôle strict de la glycémie chez tous les adultes en état critique.
Ces recommandations ont conduit à l’adoption dans le monde entier du contrôle strict de la glycémie dans un grand nombre d’unités de soins intensifs.10-14 Des essais comparatifs randomisés ultérieurs portant sur un contrôle strict de la glycémie en USI médicaux et médico-chirurgicaux15-17 n'ont toutefois pas permis de reproduire ces résultats bénéfiques en termes de mortalité. En outre, une récente étude de cohorte18 portant sur plus de 10 000 adultes en état critique a mis en évidence, après ajustement des données en fonction de la gravité de la pathologie, une tendance vers une augmentation de la mortalité avec l’augmentation de l’utilisation du contrôle strict de la glycémie. Par ailleurs, de nombreuses études ont fait état de taux élevés d’hypoglycémie en cas de contrôle strict de la glycémie, atteignant parfois 30 % à 40 %, contre les 5 % relevés dans l’essai initial de van Berghe et al.1 L’hypoglycémie n’est pas bénigne chez le patient en état critique ; elle a été associée à des événements neurologiques graves, allant de convulsions à un coma.19,20 Ceci a donné lieu à la naissance d’une controverse majeure quant à l’opportunité d’un contrôle strict de la glycémie chez l’adulte en état critique. Nous présentons ici les résultats d’une méta-analyse des essais comparatifs randomisés examinant les risques et effets bénéfiques d’un contrôle strict de la glycémie par rapport aux soins habituels chez l’adulte en état critique. Outre l’analyse générale, nous avons également réalisé des analyses de sous-groupes en fonction de deux variables sources de débat dans la controverse sur le contrôle strict de la glycémie : la cible glycémique (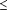 110 mg/dL ou < 150 mg/dL) et le type d’USI (médicaux, chirurgicaux ou tous les patients en état critique). 110 mg/dL ou < 150 mg/dL) et le type d’USI (médicaux, chirurgicaux ou tous les patients en état critique).
MÉTHODES
Stratégie de recherche
Nous avons effectué une recherche dans MEDLINE (de 1950 au 6 juin 2008), sans restriction de langue, afin d’identifier toutes les études en rapport avec notre question de recherche. Nous avons utilisé des descripteurs MeSH (Medical Subject Headings) explosés avec la stratégie de recherche suivante : unités soins intensifs ou soins état critique ou maladie critique ou soins postopératoires ou sepsie ou infarctus du myocarde ou accident vasculaire cérébral ou intervention chirurgicale vasculaire, ou plaies et lésions traumatiques, et glycémie ou insuline (administration et posologie, effets indésirables, usage thérapeutique, traitement). Nous avons combiné les résultats de cette recherche avec les phases 1 et 2 d’une stratégie de recherche hautement sensible21 recommandée par la Cochrane Collaboration pour identifier tous les essais comparatifs randomisés dans MEDLINE. Nous avons également effectué des recherches à partir de termes similaires dans la Cochrane Library (issue 1, 2008) et plusieurs registres d’essais (en août 2007), y compris clinicaltrials .gov (National Institutes of Health, instituts américains de santé), le registre Current Controlled Trials (permettant de procéder à des recherches dans le registre de numérotation internationale standardisée des essais cliniques randomisés International Standard Randomized Controlled Trial Number et 12 autres registres d’essais), le registre australien et néozélandais d’essais cliniques Australian New Zealand Clinical Trials Registry, et le registre japonais des essais cliniques du réseau d’information des CHU, Japan’s University Hospital Medical Information Network Clinical Trial Registry. Nous avons procédé à une recherche manuelle de résumés dans les actes de conférences de l’American Thoracic Society (de 2001 à 2008) et de la Society of Critical Care Medicine (de 2004 à 2008). En outre, nous avons passé en revue les listes bibliographiques de tous les articles pertinents afin d’identifier toute autre étude qui aurait échappé à notre recherche.
Sélection des études
Critères d'inclusion. Nous avons inclus les essais comparatifs randomisés qui remplissaient les critères suivants : (1) le lieu de l’étude était une unité de soins intensifs pour adultes ; (2) le groupe d’intervention bénéficiait d’un contrôle strict de la glycémie (cible glycémique < 150 mg/dL atteinte par une perfusion d’insuline pendant tout ou partie de l’hospitalisation en soins intensifs) ; (3) le groupe témoin recevait les soins habituels (la cible glycémique et le mode d’administration de l’insuline pouvait varier d’une étude à l’autre) ; et (4) les critères d’évaluation primaires ou secondaires incluaient la mortalité hospitalière ou à court terme (< 30 jours), la septicémie, le nouveau besoin de dialyse ou l’hypoglycémie. Pour convertir les valeurs glycémiques en mmol/L, il suffit de les multiplier par 0,0555.
Critères d'exclusion. Les études ont été exclues si l’intervention était pratiquée principalement au cours de la période peropératoire, et non pendant l’hospitalisation en USI, ou si nous n’avons pas été en mesure d’obtenir les données requises concernant la méthodologie de l’étude ou ses résultats à partir de l’article ou auprès des investigateurs de l’étude.
Données manquantes. Nous avons contacté les investigateurs de toutes les études non publiées et de toutes les études publiées pour lesquelles des données manquaient afin d’en confirmer l’admissibilité et d’obtenir plus de détails sur l’étude.
Extraction des données et évaluation de la qualité
Deux auteurs (R.S.W. et D.C.W.) ont procédé, indépendamment et sans insu, à une double extraction et évaluation des données pertinentes des essais à partir d’un formulaire prédéfini, standardisé (disponible auprès des auteurs). Les données extraites incluaient la méthodologie et le lieu de chaque étude, les caractéristiques initiales des patients, l’intervention, les critères d’évaluation et le suivi. Nous avons formellement évalué la qualité méthodologique de chaque essai au moyen de l’échelle de Jadad,22 qui se fonde sur la randomisation, l’utilisation de la technique en aveugle et le taux de perdus de vue pour établir un score compris entre 0 et cinq, les scores les plus élevés correspondant aux meilleurs niveaux de qualité. Tout désaccord entre les deux auteurs a été résolu par discussion. Les auteurs de quatre études présentées lors de réunions mais n’ayant pas encore fait l’objet de publications ont fourni les données non publiées ou les manuscrits.23-26 Les auteurs de deux autres études présentées à l’occasion de réunions17,27 et de deux études non publiées (J.R.A. Azevedo et al., janvier 2008 et R.P.C Chan et al., juillet 2007) ont complété un formulaire standardisé d’extraction de données.
Critères d’évaluation
Critère d’évaluation principal : mortalité hospitalière. Nous avons considéré une réduction de la mortalité hospitalière comme étant l’effet bénéfique potentiel le plus important du contrôle strict de la glycémie. La mortalité hospitalière a été définie comme un décès survenant au cours de l’hospitalisation ou dans les 30 jours suivant l’admission.
Critères d’évaluation secondaires : septicémie, nouveau besoin de dialyse et hypoglycémie. Nous avons comparé l’association entre un contrôle strict de la glycémie ou des soins habituels et deux autres effets bénéfiques potentiels du contrôle strict : les taux de septicémie et de nouveau besoin de dialyse. Ces critères d’évaluation ont été choisis en raison de leur plausibilité biologique, étant donnée l’association entre une hyperglycémie non contrôlée et une infection récurrente et une insuffisance rénale chronique chez le patient diabétique, et de la mise en évidence d’une réduction de ces taux dans l’essai initial mené par van den Berghe et al.1 Nous avons défini la septicémie comme incluant les termes sepsie, septicémie, bactériémie, ou une description de cultures sanguines positives ; une description générale de l’infection n’a pas été considérée comme valable. Le nouveau besoin de dialyse faisait spécifiquement référence aux patients qui n’avaient pas besoin de dialyse auparavant et qui ont développé par la suite une insuffisance rénale aiguë nécessitant une dialyse. Les critères spécifiques déterminant le besoin de dialyse n’ont pas été précisés ; cependant, les patients présentant une augmentation de la créatinine sérique ne nécessitant pas une dialyse n’entraient pas dans le cadre de cette définition. L’hypoglycémie est le principal effet nocif potentiel d’un contrôle strict de la glycémie. Dans le cadre de la définition de l’hypoglycémie, nous avons inclus les patients ayant présenté une ou plusieurs mesures glycémiques inférieures ou égales à 40 mg/dL et les essais précisant si des symptômes associés ont été signalés. Il convient de souligner que notre définition est largement inférieure au seuil de glycémie considéré par l’American Diabetes Association comme indiquant une hypoglycémie (glycémie < 70 mg/dL).9 Nous avons choisi d’utiliser cette définition stricte afin de recenser les événements hypoglycémiques suffisamment sévères pour avoir une signification clinique potentielle, indépendamment de la présence de symptômes concomitants, et car le seuil de glycémie de 40 mg/dL correspondait à la définition de l’hypoglycémie la plus fréquemment utilisée dans les essais inclus. Toutes les mesures de résultat ont été calculées par patient ; par exemple, si un patient a présenté plusieurs épisodes d’hypoglycémie, cela n’a été comptabilisé que comme un événement pour ce critère d’évaluation.
Analyses de sous-groupes
Nous avons identifié a priori deux variables permettant une analyse de sous-groupes en nous fondant sur les principales controverses soulevées dans le cadre du débat autour du contrôle strict de la glycémie : la cible glycémique et la nature de l’USI.
Cible glycémique dans le groupe bénéficiant d’un contrôle strict de la glycémie. Il existe différentes écoles concernant le niveau optimal de contrôle strict de la glycémie. En nous basant sur les recommandations de 2008 relatives au contrôle de la glycémie chez les patients en état critique de l’American Diabetes Association9 (aussi proche que possible de 110 mg/dL) et de la Surviving Sepsis Campaign4 (< 150 mg/dL), nous avons stratifié les études en deux catégories en fonction de la cible glycémique visée dans le groupe bénéficiant d’un contrôle strict de la glycémie : un contrôle très strict (limite supérieure de la cible glycémique 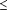 110 mg/dL) et un contrôle modérément strict (limite supérieure de la cible glycémique comprise entre 111 et 150 mg/dL). 110 mg/dL) et un contrôle modérément strict (limite supérieure de la cible glycémique comprise entre 111 et 150 mg/dL).
Nature de l’USI. Étant donnée l’hypothèse selon laquelle l’effet pathophysiologique de l’hyperglycémie pourrait être différent chez les patients médicaux et chirurgicaux en état critique, nous avons classé les essais en trois catégories en fonction du type de l’unité de soins intensifs dans laquelle étaient pris en charge les patients : (1) chirurgicaux (y compris les USI traumatiques, neurochirurgicaux, cardiothoraciques et de chirurgie générale) ; médicaux (y compris les USI neurologiques, cardiologiques et de médecine générale) ; ou (3) médico-chirurgicaux. Nous avons inclus les essais dans lesquels la nature de l’USI n’était pas précisée28-31 dans la catégorie médico-chirurgicale.
Analyses de sensibilité
Nous avons réalisé des analyses de sensibilité reposant sur trois variables cliniquement pertinentes prédéterminées : la proportion de diabétiques, l’utilisation de perfusions d’insuline seule et la glycémie moyenne effectivement obtenue dans les groupes à l’étude. Dans la mesure où l’hyperglycémie pourrait constituer ou non une réponse inadaptée nécessitant un traitement selon que le patient soit diabétique ou pas, nous avons restreint l’analyse aux essais dans lesquels seuls un tiers ou moins des participants étaient diabétiques (un seuil arbitraire fixé à partir de la répartition naturelle des diabétiques dans les essais inclus). Nous avons restreint l’analyse aux essais utilisant des perfusions d’insuline seule (par opposition aux perfusions associant glucose, insuline et potassium), car les effets de ces interventions pourraient être différents. Nous avons restreint l’analyse aux études dans lesquelles une différence d’au moins 20 mg/dL a été observée entre la glycémie moyenne du groupe bénéficiant d’un contrôle strict du glucose et celle du groupe recevant les soins habituels (une différence spécifiée a priori comme étant cliniquement significative), car les études dans lesquelles la différence atteinte n’était pas cliniquement significative auraient pu biaiser nos résultats vers le nul. En outre, pour l’analyse de sous-groupes comparant un contrôle très strict de la glycémie à un contrôle modérément strict, nous avons classé les études en fonction de la glycémie moyenne effectivement obtenue et non en fonction de la cible glycémique car, dans de nombreuses études, la cible glycémique et la glycémie effectivement atteinte dans le groupe bénéficiant d’un contrôle strict étaient disparates.
Synthèse quantitative des données
Nous avons utilisé l’approche analytique et le logiciel fourni par la Cochrane Collaboration pour toutes les analyses (Review Manager [RevMan] version 4.2, Nordic Cochrane Centre, Copenhague, Danemark). Ce logiciel calcule les risques relatifs (RR) pour les études comprenant au moins un événement pour chaque critère d’évaluation dans chacun des groupes à l’étude. Lorsqu’il manquait des données concernant un critère d’évaluation ou qu’aucun événement n’avait été observé pour un critère d’évaluation dans aucun des deux groupes à l’étude, l’essai concerné était exclu de la méta-analyse pour ce critère d’évaluation. Nous avons calculé un RR combiné et un intervalle de confiance [IC] 95 pour chaque critère d’évaluation et nous avons considéré les résultats obtenus comme étant statistiquement significatifs lorsque la valeur p du test déterminant l’effet global était inférieure à 0,05. Pour chaque critère, nous avons évalué l’importance de la variabilité entre les résultats des essais contribuant à chaque estimation combinée au moyen de deux seuils reposant sur le test  ². Nous avons considéré une valeur p inférieure à 0,10 comme indiquant une hétérogénéité statistiquement significative. Un certain degré d’hétérogénéité étant inévitable dans le cadre d’une méta-analyse, certains estiment qu’au lieu d’en évaluer la signification statistique, les auteurs devraient en étudier les effets. Une méthode consiste à procéder au test I² qui calcule le pourcentage de variation entre les résultats des essais lié à une hétérogénéité et non au hasard. Un résultat supérieur à 50 % indique une hétérogénéité significative. Dans notre méta-analyse, lorsque l’un de ces seuils indicateurs de variabilité était atteint, nous avons identifié l’essai à l’origine de cette hétérogénéité et passé en revue ses caractéristiques méthodologiques et cliniques afin de vérifier s’il y avait une explication à ces résultats divergents. Pour chaque cas de ce type, nous avons indiqué deux estimations combinées : (1) une estimation reposant sur toutes les études comprenant des données utilisables, y compris le (ou les) essai(s) dont les résultats étaient divergents, et (2) une estimation reposant sur le groupe d’études le plus important fournissant des données utilisables et en deça des seuils limites d'hétérogénéité I² et de valeur p. Il n’y a pas de consensus concernant le modèle à privilégier, entre un modèle à effets fixes et un modèle à effets aléatoires, lors du calcul des estimations combinées dans le cadre d’une méta-analyse (Cochrane Handbook for Systematic Reviews of Interventions version 5.0 ; disponible en ligne à l’adresse suivante : http://www.cochrane-handbook.org). Alors que les modèles à effets fixes donnent généralement lieu à des IC plus restreints, les deux modèles tendent à entraîner des résultats similaires, sauf en cas d’hétérogénéité entre les études incluses. Nous pensons qu’un modèle à effets aléatoires est préférable pour les méta-analyses visant à évaluer l’efficacité d’une intervention, notamment pour les analyses qui incluent des événements indésirables majeurs, car cela réduit le risque d’erreur de type 1. En outre, en cas d’hétérogénéité, le modèle à effets aléatoires est recommandé par la Cochrane Collaboration car il admet par essence la présence d’une variabilité entre les essais inclus. En conséquence, nous avons indiqué les résultats du modèle à effets aléatoires pour tous les critères d'évaluation. Par ailleurs, en cas d’absence d’hétérogénéité entre les études, nous avons également indiqué les résultats du modèle à effets fixes dans les cas où les deux modèles donnaient lieu à des résultats significativement différents. Nous avons évalué visuellement un graphique en entonnoir de la taille des études par rapport à la taille des effets pour notre critère d’évaluation principal (la mortalité hospitalière) en vue de déterminer d’éventuelles preuves de biais de publication. ². Nous avons considéré une valeur p inférieure à 0,10 comme indiquant une hétérogénéité statistiquement significative. Un certain degré d’hétérogénéité étant inévitable dans le cadre d’une méta-analyse, certains estiment qu’au lieu d’en évaluer la signification statistique, les auteurs devraient en étudier les effets. Une méthode consiste à procéder au test I² qui calcule le pourcentage de variation entre les résultats des essais lié à une hétérogénéité et non au hasard. Un résultat supérieur à 50 % indique une hétérogénéité significative. Dans notre méta-analyse, lorsque l’un de ces seuils indicateurs de variabilité était atteint, nous avons identifié l’essai à l’origine de cette hétérogénéité et passé en revue ses caractéristiques méthodologiques et cliniques afin de vérifier s’il y avait une explication à ces résultats divergents. Pour chaque cas de ce type, nous avons indiqué deux estimations combinées : (1) une estimation reposant sur toutes les études comprenant des données utilisables, y compris le (ou les) essai(s) dont les résultats étaient divergents, et (2) une estimation reposant sur le groupe d’études le plus important fournissant des données utilisables et en deça des seuils limites d'hétérogénéité I² et de valeur p. Il n’y a pas de consensus concernant le modèle à privilégier, entre un modèle à effets fixes et un modèle à effets aléatoires, lors du calcul des estimations combinées dans le cadre d’une méta-analyse (Cochrane Handbook for Systematic Reviews of Interventions version 5.0 ; disponible en ligne à l’adresse suivante : http://www.cochrane-handbook.org). Alors que les modèles à effets fixes donnent généralement lieu à des IC plus restreints, les deux modèles tendent à entraîner des résultats similaires, sauf en cas d’hétérogénéité entre les études incluses. Nous pensons qu’un modèle à effets aléatoires est préférable pour les méta-analyses visant à évaluer l’efficacité d’une intervention, notamment pour les analyses qui incluent des événements indésirables majeurs, car cela réduit le risque d’erreur de type 1. En outre, en cas d’hétérogénéité, le modèle à effets aléatoires est recommandé par la Cochrane Collaboration car il admet par essence la présence d’une variabilité entre les essais inclus. En conséquence, nous avons indiqué les résultats du modèle à effets aléatoires pour tous les critères d'évaluation. Par ailleurs, en cas d’absence d’hétérogénéité entre les études, nous avons également indiqué les résultats du modèle à effets fixes dans les cas où les deux modèles donnaient lieu à des résultats significativement différents. Nous avons évalué visuellement un graphique en entonnoir de la taille des études par rapport à la taille des effets pour notre critère d’évaluation principal (la mortalité hospitalière) en vue de déterminer d’éventuelles preuves de biais de publication.
RÉSULTATS
Résultats de la recherche et sélection des essais
Nous avons dans un premier temps identifié 1 358 études potentiellement admissibles (FIGURE 1), dont la majorité ont été exclues car elles étaient encore en cours, car il ne s’agissait pas d’essais comparatifs randomisés ou car l’intervention sur laquelle elles portaient n’était pas le contrôle strict de la glycémie. Après avoir passé en revue les 115 essais comparatifs restants, nous en avons identifié 34 (dont deux études non publiées) qui remplissaient tous les critères d’inclusion et qui ont été considérés comme pouvant potentiellement être inclus dans notre méta-analyse. 1,15-17,23-50 Par la suite, nous avons exclu un essai34 faute d’avoir pu confirmer les données détaillées de l’étude malgré plusieurs tentatives pour contacter les investigateurs, et quatre autres essais28,32,40,42 qui ne faisaient état d’aucun événement pour aucun des critères d’évaluation pertinents pour notre analyse dans aucun des groupes à l’étude. Il nous restait par conséquent 29 essais comparatifs randomisés (19 publications complètes, 1, 15, 16, 29-31, 33, 35-39, 41, 43-46, 48, 49 huit comptes-rendus disponibles sous forme de résumés uniquement,17,23-27,47,50 et deux études non publiées) portant sur 8 432 patients au total et comprenant des données utilisables dans le cadre de notre méta-analyse.
|
|

|
Figure 1. Sélection des études pour inclusion dans la méta-analyse portant sur le contrôle de la glycémie chez le patient adulte en état critique
ECR signifie essai comparatif randomisé.
|
|
|
Caractéristiques de l’étude
Le TABLEAU 1 présente les caractéristiques des 34 essais comparatifs randomisés qui remplissaient nos critères d’inclusion. Les essais, monocentriques pour la plupart, ont été réalisés dans des pays des quatre coins du monde. Leur taille variait considérablement (de 10 à plus de 1 500 patients), 21 essais portant sur moins de 100 patients et sept autres incluant plus de 500 patients. Parmi les participants des études figuraient divers types de patients adultes hospitalisés en USI, comme en témoignent les différences en termes d’âges moyens (de 46 à 75 ans), de répartition par sexe (de 31 % à 95 % d’hommes), de proportion de patients diabétiques (de 0 à 100 %) et de degré de gravité de la pathologie, mesurée au moyen du score APACHE II (Acute Physiology and Chronic Health Evaluation) moyen (compris entre 9 et 32). Seules deux études29,46 comprenaient une disparité entre les caractéristiques initiales des patients dans le groupe d’intervention et le groupe témoin. Dans ces deux études, la gravité des pathologies était plus faible dans le groupe ayant bénéficié d’un contrôle strict de la glycémie que dans le groupe ayant reçu les soins habituels (scores APACHE II moyens : 14 contre 17 dans l’essai mené par Wang et al.29, et 19 contre 22, p < 0,01 dans l’essai réalisé par Mitchell et al.46). Tous les essais comprenaient des taux de suivi supérieurs ou égaux à 80 %. Aucun des essais ne comprenant de répartition en double aveugle des patients dans les groupes à l’étude, aucun d’eux n’a pu obtenir de score de qualité de Jadad supérieur à trois ou cinq. Les cibles glycémiques visées et les glycémies moyennes effectivement obtenues variaient d’un essai à l’autre dans les groupes ayant bénéficié d’un contrôle strict de la glycémie et dans les groupes ayant reçu les soins habituels (TABLEAU 2).
|
|

|
|
Tableau 1. Caractéristiques des essais comparatifs randomisés comparant un contrôle strict de la glycémie aux soins habituels chez le patient adulte en état critique remplissant tous les critères d’inclusion
|
|
|
|
|

|
|
Tableau 2. Cibles glycémiques et glycémies moyennes obtenues dans les essais inclus dans la méta-analyse finale
|
|
|
Critère d’évaluation principal : mortalité hospitalière
Vingt sept études, dont deux non publiées, ont fourni des données utilisables concernant la mortalité hospitalière.1, 15-17, 23-27, 29, 30, 35-39, 41, 43-50 Dans ces essais, aucune différence significative n’a été observée en termes de mortalité hospitalière entre la stratégie de contrôle strict de la glycémie et les soins habituels (21,6 % contre 23,3 % ; RR = 0,93 [IC95 : 0,85-1,03] ; FIGURE 2). Nous avons également réalisé des analyses de sous-groupes en stratifiant les essais en fonction du type d’USI et de la cible glycémique dans le groupe ayant bénéficié d’un contrôle strict de la glycémie. Aucune différence significative en termes de mortalité hospitalière n’a été mise en évidence en cas de stratification en fonction du type d’unité de soins intensifs : chirurgicaux (8,8 % contre 10,8 % ; RR = 0,88 [IC95 : 0,63-1,22]), médicaux (26,9 % contre 29,7 % ; RR = 0,92 [IC95 : 0,82-1,04]) et médico-chirurgicaux (26,1 % contre 27,0 % ; RR = 0,95 [IC95 : 0,80-1,13] ; Figure 2). De la même façon, aucune différence significative n’a été observée en termes de mortalité hospitalière entre la stratégie de contrôle strict de la glycémie et les soins habituels, en cas de stratification en fonction de la cible glycémique dans le groupe ayant bénéficié d’un contrôle strict (très strict : 23,2 % contre 25,2 % ; RR = 0,90 [IC95 : 0,77-1,04] ; et modérément strict : 17,3 % contre 18,0 % ; RR = 0,99 [IC95 : 0,83-1,18] ; FIGURE 3). Les tests d’hétérogénéité ont montré que l’essai mené par Wang et al.29 présentait des résultats divergents par rapport aux sous-groupes d’essais portant sur les USI médico-chirurgicaux (p = 0,03, I² = 48 %) et ceux portant sur le contrôle très strict de la glycémie (p = 0,02, I² = 49 %), qui semblent pouvoir être expliqués par les disparités précédemment mentionnées concernant la gravité initiale de la pathologie, lors de l’inclusion dans l’essai. L’exclusion de l’essai ayant obtenu des résultats divergents29 a résolu le problème de cette hétérogénéité mais n’a pas entraîné de modification significative concernant les résultats des analyses de sous-groupes (USI médico-chirurgicaux : RR = 1,00 [IC95 : 0,90-1,11], contrôle très strict de la glycémie : RR = 0,94 [IC95 : 0,84-1,05]).
|
|

|
Figure 2. Association entre un contrôle strict de la glycémie et la mortalité hospitalière, par rapport aux soins habituels, stratifiée en fonction de la nature de l’USI et de la cible glycémique visée dans le groupe ayant bénéficié d’un contrôle strict de la glycémie
USI : unité de soins intensifs.
aCes données ont été obtenues de sources non publiées (voir la section « Extraction des données et évaluation de la qualité »).
bTest d’hétérogénéité pour les patients d’USI chirurgicaux : I² = 17 % ; p = 0,30.
cTest d’hétérogénéité pour les patients d’USI médicaux : I² = 0 % ; p = 0,98.
dTest d’hétérogénité pour les patients d’USI médico-chirurgicaux : I² = 48 %, p = 0,03. En cas d’exclusion de l’essai mené par Wang et al., 29 présentant des disparités concernant la gravité initiale des maladies, le risque relatif combiné obtenu est égal à 1,00 [intervalle de confiance 95 : 0,90-1,11], test d’hétérogénéité : I² = 0 % ; p = 0,47.
eTest d’hétérogénéité pour tous les patients en état critique : I² = 18 % ; p = 0,20.
fLe centre du marqueur indique l’estimation ponctuelle du risque relatif ; sa largeur est proportionnelle au poids attribué à l’étude et la longueur de la ligne représente l’intervalle de confiance 95.
|
|
|
|
|

|
Figure 3. Association entre un contrôle strict de la glycémie et différents critères d’évaluation chez l'adulte en état critique, par rapport aux soins habituels, stratifiée en fonction de la cible glycémique visée dans le groupe ayant bénéficié d'un contrôle strict de la glycémie
aTests d’hétérogénéité pour la mortalité hospitalière : contrôle très strict de la glycémie : I² = 49 %, p = 0,02 ; contrôle modérément strict de la glycémie : I² = 0 %, p = 0,92 ; totale : I² = 18 %, p = 0,20. Les résultats suivants ont été obtenus après exclusion de l'essai mené par Wang et al.29 : risque relatif pour le groupe ayant bénéficié d’un contrôle très strict de la glycémie = 0,94 [intervalle de confiance 95 : 0,84-1,05], test d'hétérogénéité : I² = 19 %, p = 0,25.
bTests d’hétérogénéité pour la septicémie : contrôle très strict de la glycémie : I² = 64 %, p = 0,04 ; contrôle modérément strict de la glycémie : I² = 0 %, p = 0,63 ; total : I² = 35 %, p = 0,14.Les résultats suivants ont été obtenus après exclusion de l'essai mené par van den Berghe1 : risque relatif pour le groupe ayant bénéficié d’un contrôle très strict de la glycémie = 0,92 [intervalle de confiance 95 : 0,71-1,20], test d'hétérogénéité : I² = 31 %, p = 0,24.
cTests d’hétérogénéité pour le nouveau besoin de dialyse : contrôle très strict de la glycémie : I² = 55 %, p = 0,06 ; contrôle modérément strict de la glycémie : I² = 0 %, p = 0,64 ; total : I² = 25 %, p = 0,22.Les résultats suivants ont été obtenus après exclusion de l'essai mené par van den Berghe1 : risque relatif pour le groupe ayant bénéficié d’un contrôle très strict de la glycémie = 1,13 [intervalle de confiance 95 : 0,91-1,40], test d'hétérogénéité : I² = 0 %, p = 0,86.
dTests d'hétérogénéité pour l'hypoglycémie : contrôle très strict de la glycémie : I² = 0 %, p = 0,48 ; contrôle modérément strict de la glycémie : I² = 0 %, p =0,91 ; total : I² = 0 %, p = 0,74.
eLe centre du marqueur indique l’estimation ponctuelle du risque relatif et la longueur de la ligne représente l’intervalle de confiance 95. La taille des marqueurs reflète le poids des différentes études.
|
|
|
Critères d’évaluation secondaires : septicémie, nouveau besoin de dialyse et hypoglycémie.
La Figure 3 indique les associations entre un contrôle strict de la glycémie et les différents critères d’évaluation secondaires analysés et stratifiés en fonction de la cible glycémique utilisée dans le groupe ayant bénéficié d’un contrôle strict de la glycémie. La FIGURE 4 présente les associations entre un contrôle strict de la glycémie et les différents critères d’évaluation, classifiés en fonction du type d’USI (les données relatives à ces critères sont disponibles sur demande auprès des auteurs).
|
|

|
Figure 4. Association entre un contrôle strict de la glycémie et différents critères d’évaluation chez l'adulte en état critique, par rapport aux soins habituels, stratifiée en fonction de la nature du l'USI
USI : unité de soins intensifs.
aTests d’hétérogénéité pour la mortalité hospitalière : USI chirurgicaux : I² = 17 %, p = 0,30 ; USI médicaux : I² = 0 %, p = 0,98 ; USI médico-chirurgicaux : I² = 48 %, p = 0,03 ; total : I² = 18 %, p = 0,20. Les résultats suivants ont été obtenus après exclusion de l’essai mené par Wang et al.29 : risque relatif pour le groupe admis en USI médico-chirurgicaux = 1,00 [intervalle de confiance 95 : 0,90-1,11], test d'hétérogénéité : I² = 0 %, p = 0,47.
bTests d’hétérogénéité pour la septicémie : USI chirurgicaux : I² = 0 %, p = 0,73 ; USI médicaux : non applicable ; USI médico-chirurgicaux : I² = 0 %, p = 0,49 ; total : I² = 35 %, p = 0,14.
cTests d’hétérogénéité pour le nouveau besoin de dialyse : USI chirurgicaux : I² = 30 %, p = 0,24 ; USI médicaux : non applicable ; USI médico-chirurgicaux : I² = 0 %, p = 0,96 ; total : I² = 25 %, p = 0,22. En utilisant un modèle à effets fixes pour les données relatives aux USI chirurgicaux : risque relatif = 0,64 [intervalle de confiance 95 : 0,45-0,92].
dTests d'hétérogénéité pour l'hypoglycémie : USI chirurgicaux : I² = 0 %, p = 0,83 ; USI médicaux : I²= 51 %, p = 0,15 ; USI médico-chirurgicaux : I² = 0 %, p = 0,51 ; total : I² = 0 %, p = 0,74.
eLe centre du marqueur indique l’estimation ponctuelle du risque relatif et la longueur de la ligne représente l’intervalle de confiance 95. La taille des marqueurs reflète le poids des différentes études.
|
|
|
Les taux de septicémie ont été étudiés dans neuf essais.1, 15, 23, 26, 30, 35-37, 48 Un contrôle strict de la glycémie a été associé à une réduction significative du risque de septicémie, par rapport aux soins habituels (10,9 % contre 13,4 % ; RR = 0,76 [IC95 : 0,59-0,97]). En cas de stratification en fonction du type d’USI, cette réduction du risque de septicémie était limitée aux patients admis en USI chirurgicaux1, 23, 35-37 (4,6 % contre 8,4 % ; RR = 0,54 [IC95 : 0,38-0,76]) et n’était pas observée chez les patients pris en charge en USI médicaux15 ou médico-chirurgicaux26, 30, 48 (Figure 4). En cas de stratification en fonction de la cible glycémique visée dans le groupe ayant bénéficié d’un contrôle strict de la glycémie (Figure 3), une réduction quasi-significative du risque de septicémie, limitée aux études portant sur un contrôle modérément strict de la glycémie, a été observée (8,8 % contre 14,6 % ; RR = 0,64 [IC95 : 0,41-1,00]). Le test d’hétérogénéité était uniquement significatif pour le sous-groupe d’essais portant sur un contrôle très strict de la glycémie (p = 0,04 ; I² = 64 %). Nous avons identifié l’essai mené par van den Berghe et al.1 dans une unité de soins intensifs chirurgicaux comme étant l’étude dont les résultats étaient divergents, mais nous n’avons pas été en mesure d’identifier de raison évidente pour ces résultats. L’analyse limitée aux études présentant des résultats homogènes n’a pas modifié nos résultats montrant une réduction non significative du taux de septicémie dans le sous-groupe d’essais portant sur le contrôle très strict de la glycémie. Le nouveau besoin de dialyse a été étudié dans huit essais publiés1, 16, 23, 25, 26, 30, 35, 50 et dans un essai non publié (Azevedo). Dans l’ensemble, aucune association significative n’a été relevée entre un contrôle strict de la glycémie et un nouveau besoin de dialyse (11,2 % contre 12,1 % ; RR = 0,96 [IC95 : 0,76-1,20]). Les analyses de sous-groupes stratifiées en fonction de la cible glycémique (Figure 3) et du type d’USI (Figure 3) n’ont pas non plus montré d’association significative entre un contrôle strict de la glycémie et un nouveau besoin de dialyse. Le test d’hétérogénéité n’était significatif (p = 0,06 ; I² = 55 %) que pour le sous-groupe d’essais évaluant un contrôle très strict de la glycémie ; une fois encore, l'essai mené par van den Berghe1 dans une unité de soins intensifs chirurgicaux présentait des résultats divergents. Que cet essai divergent soit exclu ou non, les résultats n’étaient pas statistiquement significatifs (Figure 3). Inversement, le sous-groupe d'essais1, 23, 35 menés dans les unités de soins intensifs chirurgicaux (Figure 4) dépassaient les deux seuils d'hétérogénéité et les estimations combinées variaient selon le modèle utilisé. Alors que les résultats obtenus au moyen d’un modèle à effets aléatoires n'étaient pas significatifs (RR = 0,69 [IC95 : 0,38-1,26]), l’utilisation d'un modèle à effets fixes a montré une réduction significative du nouveau besoin de dialyse (RR = 0,64 [IC95 : 0,45-0,92]). L’hypoglycémie a été étudiée dans 14 essais publiés 1, 15-17, 23, 25, 26, 31, 33, 37, 38, 46, 47, 50 et dans un essai non publié (Azeved). Un contrôle strict de la glycémie a été associé à une augmentation du risque d’hypoglycémie (13,7 % contre 2,5 % ; RR = 5,13 [IC95 : 4,09-6,43]). Comme on peut s'y attendre, dans le cadre d’une comparaison par rapport aux soins habituels, le risque d'hypoglycémie était plus élevé chez les patients ayant bénéficié d'un contrôle très strict de la glycémie que chez ceux ayant bénéficié d’un contrôle modérément strict de la glycémie (Figure 3). Le risque augmenté d’hypoglycémie était relativement cohérent quelle que soit la nature de l'unité de soins intensifs (Figure 4). Une hétérogénéité (I² = 51 %) a été relevée entre les essais portant sur des unités de soins intensifs médicaux, mais ce sous-groupe ne comptant que deux essais,15, 38 nous ne sommes pas en mesure de déterminer l’essai à l’origine de la disparité observée. Nous pensons toutefois que l’essai38 portant sur huit patients et n'indiquant aucune augmentation du risque d'hypoglycémie est moins fiable que l'étude menée à plus grande échelle15 ayant mis en évidence une augmentation significative du risque. Alors que la plupart des essais ont indiqué qu’aucun ou que seuls de rares épisodes d’hypoglycémie étaient associés à des symptômes manifestes, certaines études ont montré que les patients ayant eu une hypoglycémie présentaient un risque de mortalité plus élevé.15, 16, 26
Analyses de sensibilité
Pour chacune de nos analyses de sensibilité (le fait de restreindre l’analyse aux essais dans lesquels la proportion de patients diabétiques était inférieure ou égale à 34 %, aux essais utilisant uniquement des perfusions d’insuline, aux essais dans lesquels une différence d’au moins 20 mg/dL a été observée entre les glycémies moyennes des groupes à l'étude, et la stratification des essais en fonction de la glycémie effectivement obtenue dans le groupe de contrôle strict de la glycémie), les différences relatives aux estimations ponctuelles étaient minimes pour la plupart des critères d’évaluation. Ces estimations ponctuelles comptant des variations modérées restaient comprises dans de larges intervalles de confiance. Un changement en termes de signification statistique a été observé pour deux résultats seulement, en cas de stratification en fonction de la glycémie effectivement obtenue : la réduction du risque de septicémie est devenue statistiquement significatif dans le sous-groupe d'essais portant sur un contrôle très strict de la glycémie (RR = 0,58 [IC95 : 0,42-0,80]), alors que dans les essais portant sur un contrôle modérément strict de la glycémie, la réduction du taux de septicémie n’était plus significative (RR = 0,87 [IC95 : 0,63-1,21]).
Biais de publication
Lors de l’évaluation visuelle du graphique en entonnoir relatif à la mortalité hospitalière, nous n’avons observé aucune preuve de biais de publication (données non présentées).
DISCUSSION
Dans cette méta-analyse d’essais comparatifs randomisés comparant un contrôle strict de la glycémie aux soins habituels chez le patient adulte en état critique, nous n'avons observé aucune différence significative en termes de mortalité hospitalière ou de nouveau besoin de dialyse. Bien qu’un contrôle strict de la glycémie ait été associé à une réduction significative du risque total de septicémie, une analyse de sous-groupes à suggéré que cet effet bénéfique était limité aux patients admis en USI chirurgicaux. En revanche, nous avons mis en évidence des preuves claires des principaux effets nocifs associés au contrôle strict de la glycémie : une multiplication par cinq environ du risque d'hypoglycémie, quelle que soit la nature du service de soins intensifs, et une hypoglycémie plus fréquente chez les patients ayant bénéficié d'un contrôle très strict de la glycémie par rapport à ceux ayant bénéficié d'un contrôle modérément strict. En résumé, notre méta-analyse ne rejoint pas les conclusions de l’essai initial mené par van den Berghe et al.1 concernant les effets bénéfiques d’un contrôle strict de la glycémie, mais suggère un risque bien plus élevé d’hypoglycémie.
Notre étude comporte toutefois plusieurs limitations. Dans la mesure où nous avons combiné les résultats d’essais individuels, notre analyse est limitée par les éventuelles lacunes méthodologiques de ces différents essais. Même si aucun des essais inclus n’a utilisé de répartition en double aveugle des patients dans les groupes à l’étude, ce qui pourrait constituer une source de biais si les patients avaient été traités différemment, l'investigateur ayant connaissance du groupe auquel ils appartenaient, tous les essais sont parvenus à un bon équilibre concernant les caractéristiques initiales pertinentes, à l’exception des disparités indiquées, et comprenaient un taux de suivi supérieur à 80 %. Dans ces études en ouvert, le risque d'un traitement différent est le plus prononcé pour le critère d'évaluation du nouveau besoin de dialyse, qui a de fortes chances d'être déterminé de façon subjective, au moins en partie, par les médecins traitants.
Bien que plusieurs études incluses aient été menées à petite échelle, les principales limitations de ce type d'essais (un manque de puissance et une faible possibilité de généralisation) sont atténuées par leur intégration dans le cadre d'une méta-analyse, et l'exclusion de ces études pourrait être une source de biais. Malgré une puissance accrue du fait de la combinaison d'un grand nombre d'études, notre méta-analyse risque toutefois de ne pas être suffisamment puissante pour déceler de faibles différences entre la stratégie du contrôle strict de la glycémie et les soins habituels concernant les critères d'évaluation étudiés. Par exemple, pour notre critère d’évaluation principal de mortalité hospitalière, la puissance de notre méta-analyse (en considérant que  = 0,05 et la puissance = 0,8) est suffisante pour déterminer la signification statistique d’une différence absolue de 2,6 % en termes de mortalité (20,7 % contre 23,3 %), mais pas de la différence de 1,7 % en termes de mortalité effectivement identifiée dans cette méta-analyse (21,6 % contre 23,3 %). Pour disposer d’une puissance suffisante permettant de considérer une différence de 1,7 % entre les groupes comme statistiquement significative, l'analyse devrait porter sur quelque 19 146 patients. Il existait des différences considérables concernant les caractéristiques initiales des patients et les protocoles de perfusion d'insuline entre les essais inclus dans notre méta-analyse. Cependant, cette diversité, qui ne semble pas avoir influencé les tests d’hétérogénéité, à l'exception des points soulevés, nous a permis de couvrir l'ensemble des adultes en état critique et des procédures de soins en USI. En outre, une analyse de sensibilité basée sur des variables ayant une pertinence clinique potentielle n’a entraîné aucun changement majeur concernant nos résultats, ce qui encourage la combinaison de grandes études représentatives. Néanmoins, dans la mesure où il serait raisonnable de s’attendre à ce que nos résultats négatifs combinés incluent des sous-groupes importants pour lesquels un contrôle strict de la glycémie pourrait avoir des effets bénéfiques, nous avons présenté les résultats obtenus en les stratifiant en fonction des variables les plus controversées, à savoir la cible glycémique visée dans le groupe ayant bénéficié d'un contrôle strict de la glycémie et le type USI. = 0,05 et la puissance = 0,8) est suffisante pour déterminer la signification statistique d’une différence absolue de 2,6 % en termes de mortalité (20,7 % contre 23,3 %), mais pas de la différence de 1,7 % en termes de mortalité effectivement identifiée dans cette méta-analyse (21,6 % contre 23,3 %). Pour disposer d’une puissance suffisante permettant de considérer une différence de 1,7 % entre les groupes comme statistiquement significative, l'analyse devrait porter sur quelque 19 146 patients. Il existait des différences considérables concernant les caractéristiques initiales des patients et les protocoles de perfusion d'insuline entre les essais inclus dans notre méta-analyse. Cependant, cette diversité, qui ne semble pas avoir influencé les tests d’hétérogénéité, à l'exception des points soulevés, nous a permis de couvrir l'ensemble des adultes en état critique et des procédures de soins en USI. En outre, une analyse de sensibilité basée sur des variables ayant une pertinence clinique potentielle n’a entraîné aucun changement majeur concernant nos résultats, ce qui encourage la combinaison de grandes études représentatives. Néanmoins, dans la mesure où il serait raisonnable de s’attendre à ce que nos résultats négatifs combinés incluent des sous-groupes importants pour lesquels un contrôle strict de la glycémie pourrait avoir des effets bénéfiques, nous avons présenté les résultats obtenus en les stratifiant en fonction des variables les plus controversées, à savoir la cible glycémique visée dans le groupe ayant bénéficié d'un contrôle strict de la glycémie et le type USI.
Notre méta-analyse indique que les essais ultérieurs n’ont pas corroboré les résultats impressionnants que promettait l'essai initial de van den Berghe et al.1 en cas de contrôle strict de la glycémie. Les tests d'hétérogénéité ont identifié cet essai comme comprenant des résultats divergents par rapport aux essais comparatifs randomisés réalisés par la suite qui étudiaient les critères d’évaluation de la septicémie et du nouveau besoin de dialyse. Au moins trois raisons peuvent expliquer les différences observées entre les résultats de cet essai et ceux des études ultérieures : un biais, le hasard et des pratiques cliniques atypiques.
Même si le fait qu'il s'agissait d'un essai ouvert pourrait être source de biais, aucun des autres essais n’a été réalisé en aveugle, et nous ne pensons pas que cela puisse expliquer les divergences entre les résultats des études. L’essai initial de van den Berghe et al.,1 a fait état d’un taux de mortalité inhabituellement élevé dans le groupe ayant reçu les soins habituels, en se fondant sur le degré de gravité des pathologies, un résultat pouvant être dû au hasard. Par ailleurs, plusieurs aspects de cet essai ont fait l’objet de critiques51, 53 du fait de l’utilisation de pratiques cliniques atypiques. En particulier, l’utilisation précoce d’une perfusion de glucose et de la nutrition parentérale, susceptibles d'avoir entraîné artificiellement une hyperglycémie, pourrait avoir contribué aux résultats divergents observés dans cet essai.
La population chirurgicale, et peut-être même plus particulièrement les patients de chirurgie cardiaque, qui formaient le noyau des participants à l'essai initial de van den Berghe et al.1, pourraient constituer le groupe pour lequel un contrôle strict de la glycémie pourrait s'avérer le plus bénéfique. Cependant, notre méta-analyse a montré que les essais comparatifs randomisés ultérieurs portant sur cette intervention chez des patients chirurgicaux n'ont pas confirmé de réduction significative de la mortalité, une observation confortée par une analyse de sous-groupes axée sur les patients chirurgicaux (n = 6 431) dans le cadre d’une étude de cohorte récente réalisée à grande échelle.18 En outre, les essais comparatifs randomisés ultérieurs portant sur un contrôle strict de la glycémie pendant54 ou après (données non publiées de Chan et al.) une intervention de chirurgie cardiaque n’ont pas non plus confirmé de réduction de la mortalité associée à un contrôle strict de la glycémie.
Des problèmes pratiques inhérents à la mise en œuvre d’un contrôle strict de la glycémie ont été relevés dans et en dehors du cadre de essais cliniques. Il peut être difficile d’atteindre la cible glycémique visée en pratique ; même dans les conditions d'étroite supervision d'un essai clinique, sur les 29 études incluses dans notre méta-analyse, quatre études publiées et deux études non publiées (21 %) ne sont pas parvenues à atteindre une glycémie moyenne comprise dans une fourchette de 5 mg/dL autour de la cible glycémique spécifiée pour le groupe bénéficiant d'un contrôle strict de la glycémie17, 24, 25, 41 (et données non publiées de Chan et al. et Azevedo et al.). Dans la pratique, le personnel infirmier s’est avéré particulièrement réticent à respecter scrupuleusement le contrôle strict de la glycémie, en raison de l'augmentation de la charge de travail résultant de la nécessité d'un contrôle glycémique fréquent et des variations de la vitesse de perfusion, d’une part, et de préoccupations concernant le risque d’hypoglycémie, d’autre part.53, 55, 56 Ces préoccupations concernant l'hypoglycémie semblent justifiées, comme en témoigne l'augmentation significative du risque d'hypoglycémie dans notre méta-analyse. On ne sait pas si ces événements d’hypoglycémie sont un facteur causal dans le décès des patients ou s'ils ne sont qu'un marqueur de la gravité de la pathologie.
Dans l’ensemble, nous estimons que les 29 essais inclus dans notre méta-analyse nous permettent de formuler des conclusions concernant les effets bénéfiques et les risques d’un contrôle strict de la glycémie dans le vaste groupe des adultes en état critique. Nous avons établi qu’un contrôle strict de la glycémie n’était pas associé à une réduction significative de la mortalité hospitalière ni du nouveau besoin de dialyse, mais était associé à un risque nettement augmenté d'hypoglycémie. Bien que nous ayons observé une association statistiquement significative entre le contrôle strict de la glycémie et une réduction du taux de septicémie, cette réduction pourrait concerner les épisodes de septicémie les moins sévères, puisqu'elle n'a pas été associée à une réduction de la mortalité hospitalière. En outre, en cas de stratification en fonction du type d’USI, l'association significative à une réduction du risque de septicémie était limitée aux essais menés dans les unités de soins intensifs chirurgicaux. Étant donné les résultats généraux de cette méta-analyse, une réévaluation des directives recommandant un contrôle strict de la glycémie chez tous les patients en état critique semble justifiée, jusqu'à ce que les résultats d'essais cliniques plus définitifs et menés à plus grande échelle soient disponibles.
Informations sur les auteurs
Correspondance : Renda Soylemez Wiener, Docteur en médecine, Titulaire d’un Master en santé publique, VA Outcomes Group, 111 B, Department of Veterans Affairs Medical Center, White River Junction, VT 05009 (États-Unis) (renda.s.wiener{at}dartmouth.edu).
Contributions des auteurs : Le Dr Soylemez Wiener avait accès à toutes les données de l'étude et est responsable de l'intégrité des données et de l'exhaustivité de leur analyse.
Méthodologie et conception de l’étude : Soylemez Wiener, D. Wiener, Larson.
Recueil des données : Soylemez Wiener, D. Wiener.
Analyse et interprétation des données : Soylemez Wiener, D. Wiener, Larson.
Ébauche du manuscrit : Soylemez Wiener, D. Wiener, Larson.
Révision critique du contenu intellectuel principal du manuscrit : Soylemez Wiener, D. Wiener, Larson.
Analyse statistique : Soylemez Wiener, Larson.
Supervision de l’étude : Larson.
Déclarations de conflits d’intérêts : aucun n’a été signalé.
Financement/soutien : cette étude a reçu le soutien de la Dartmouth Medical School (Dr Soylemez Wiener) ; du Dartmouth Hitchcock Medical Center (Dr D. Wiener) et du Department of Veterans Affairs [département américain des anciens combattants] (Dr Larson).
Rôle du promoteur : les promoteurs n’ont joué aucun rôle ni dans la conception et le déroulement de l'étude, ni dans le recueil, la gestion, l’analyse et l’interprétation des données ou dans la préparation, la révision ou l'approbation du manuscrit.
Décharge : les opinions exprimées dans cette publication ne reflètent pas nécessairement celles du département américain des anciens combattants ou du gouvernement américain.
Autres contributions : nous remercions Samuel R. G. Finlayson, Docteur en médecine, titulaire d’un Master en santé publique, et Paul S. Wright, titulaire d’un Master en santé publique, pour leur aide bénévole à la traduction des articles. Nous remercions également H. Gilbert Welch, docteur en médecine, titulaire d’un Master en santé publique, pour sa critique non rémunérée de cet article. Le Dr Finlayson, M. Wright et le Dr Welsh sont tous affiliés au Darthmouth Institute for Health Policy and Clinical Practice, Dartmouth Medical School. Enfin, nous aimerions remercier nos collègues du VA Outcomes Group pour leur contribution bénévole, leurs précieux commentaires nous ayant permis d'approfondir notre réflexion et d'optimiser la présentation de nos résultats.
Affiliations des auteurs : VA Outcomes Group, Department of Veterans Affairs Medical Center, White River Junction, Vermont (États-Unis), et Dartmouth Institute for Health Policy and Clinical Practice, Dartmouth Medical School, Hanover, New Hampshire (États-Unis) (Dr Soylemez Wiener et Larson), et Dartmouth-Hitchcock Medical Center, Lebanon, New Hampshire (États-Unis) (Dr Wiener).
Rédacteur de la section Prise en charge du patient en état critique : Derek C. Angus, Docteur en médecine, Titulaire d’un Master en santé publique, conseiller de rédaction, JAMA (angusdc{at}upmc.edu).
Pour lire l’éditorial, voir page 963.
FMC disponible en ligne à www.jamaarchivescme.comet questions p. 972.
BIBLIOGRAPHIE
 |  |
1. van den Berghe G, Wouters P, Weekers F, et al.. Intensive insulin therapy in the critically ill patients. N Engl J Med. 2001 ; n 345(19), pp.1359-1367.2. Malhotra A.. Intensive insulin in intensive care. N Engl J Med. 2006 ; n° 354(5), pp. 516-518.3. Dellinger RP, Carlet J, Masur H, et al.. Surviving sepsis campaign guidelines for management of severe sepsis and septic shock. Intensive Care Med. 2004 ; n° 30(4), pp. 536-555.4. Dellinger RP, Levy M, Carlet J, et al.. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2008. Intensive Care Med. 2008 ; n° 34(1), pp. 17-60.5. Institute for Healthcare Improvement. Implement effective glucose control: establish a glycemic control policy in your ICU. http://www.ihi.org/IHI/Topics/CriticalCare/IntensiveCare/Changes/Individual-Changes/EstablishaGlycemicControlPolicyinYourICU.htm. Consulté le 2 février 2008.6. Volunteer Hospital Association. Homepage. http://www.vha.com. Consulté le 24 mars 2008.7. Michigan Health and Safety Coalition. A toolkit for intensive care units to improve the safety and quality of patient care. http://www.mihealthandsafety.org/icu/9.htm. Consulté le 24 mars 2008.8. AACE Diabetes Mellitus Clinical Practice Guidelines Task Force. American Association of Clinical Endocrinologists medical guidelines for clinical practice for the management of diabetes mellitus. Endocr Pract. 2007; n° 13(suppl 1), p. 1-68.9. American Diabetes Association. Standards of medical care in diabetes–2008. Diabetes Care. 2008; n° 31(suppl 1), S12-S54.10. Mackenzie I, Ingle S, Zaidi S, Buczaski S.. Tight glycaemic control: a survey of intensive care practice in large English hospitals. Intensive Care Med. 2005 ; n° 31(8), p. 1136.11. McMullin J, Brozek J, Jaeschke R, et al.. Glycemic control in the ICU: a multicenter survey. Intensive Care Med. 2004 ; n° 30(5), pp. 798-803.12. Schultz MJ, Spronk P, Moeniralam H. Tight glycaemic control: a survey of intensive care practice in the Netherlands. Intensive Care Med. 2006 ; n° 32 (4), pp. 618-619.13. Mitchell I, Finfer S, Bellomo R, Higlett T.; Anzics Clinical Trials Group Glucose Management Investigators. Management of blood glucose in the critically ill in Australia and New Zealand: a practice survey and inception cohort study. Intensive Care Med. 2006 ; n° 32(6), pp. 867-874.14. Hirshberg E, Lacroix J, Sward K, Willson D, Morris AH. Blood glucose control in critically ill adults and children:a survey on stated practice [published online ahead of print March 13, 2008]. Chest. 2008 ; n° 133 (6), pp. 1328-1335.15. van den Berghe G, Wilmer A, Hermans G, et al.. Intensive insulin therapy in the medical ICU. N Engl J Med. 2006 ; n° 354(5), pp. 449-461.16. Brunkhorst FM, Engel C, Bloos F, et al.. Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med. 2008 ; n° 358(2), pp. 125-139.17. Devos P, Preiser J, Melot C.. Impact of tight glucose control by intensive insulin therapy on ICU mortality and the rate of hypoglycaemia: final results of the glucontrol study [résumé 0735 du 20ème Congrès annuel de l’European Society of Intensive Care Medicine]. Intensive Care Med. 2007; n° 33(suppl 2), S189.18. Treggiari MM, Karir V, Yanez ND, Weiss N, Daniel S, Deem S. Intensive insulin therapy and mortality in critically ill patients. Crit Care. 2008 ; n° 12(1), R29.19. Vriesendorp TM, DeVries JH, van Santen S, et al.. Evaluation of short-term consequences of hypoglycemia in an intensive care unit. Crit Care Med. 2006 ; n° 34(11), pp. 2714-2718.20. Mechanick JI, Handelsman Y, Bloomgarden ZT. Hypoglycemia in the intensive care unit. Curr Opin Clin Nutr Metab Care. 2007 ; n° 10(2), pp. 193-196.21. Robinson KA, Dickersin K. Development of a highly sensitive search strategy for the retrieval of reports of controlled trials using PubMed. Int J Epidemiol. 2002 ; n° 31(1), pp. 150-153.22. Jadad AR, Moore RA, Carroll D, et al.. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996 ; n° 17 (1), pp. 1-12.23. Kia M, Botdorf J, Barber KR, et al.. The effects of strict glycemic control in the critically ill general and vascular surgical patient. Article présenté à l’occasion du 91ème Congrès annuel de l’American College of Surgeons, tenu du 16 au 20 octobre 2005 à San Francisco, Californie.24. Fernandez R, Boque M, Galera A. Rodriguez-CintronW. Insulin: effect on mortality and renal failure in medical intensive care unit patients [abstract]. Proc Am Thorac Soc. 2005; n° 2, A37.25. Mackenzie IM, Ingle S, Underwood C, Blunt M. Glycaemic control and outcome in general intensive care [abstract]. Proc Am Thorac Soc. 2005; n° 2, A295.26. Arabi Y, Dabbagh O, Tamim H, et al.. Intensive versus standard insulin therapy: a randomized controlled trial in medical surgical critically ill patients [abstract]. Crit Care Med. 2006 ; n° 34(12) (suppl), A65.27. Stecher A, Steblaj S, Kremzar B, Ivanova E.. The influence of normoglycemia on ventilator-associated pneumonia in trauma patients. Article présenté à l’occasion de l’European Trauma Congress, tenu du 24 au 26 mai 2006 à Ljubljana, Slovénie.28. Saberi AA, Orme J, Clemmer T, et al.. A safe computerized protocol for lower ICU blood glucose [abstract]. Proc Am Thorac Soc. 2004 ; n °1, A38.29. Wang LC, Lei S, Wu YC, et al.. Intensive insulin therapy in critically ill patients. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue. 2006 ; n° 18(12), pp. 748-750.30. Yu WK, Li WQ, Wang XD, et al.. Influence and mechanism of a tight control of blood glucose by intensive insulin therapy on human sepsis. Zhonghua Wai Ke Za Zhi. 2005 ; n° 43(1), pp. 29-32.31. Iapichino G, Albicini M, Umbrello M, et al.. Tight glycemic control does not affect asymmetricdimethylarginine in septic patients [publié en ligne avant impression le 27 mai 2008]. Intensive Care Med. doi:10.1007/s00134-008-1158-9.32. Hoedemaekers CW, Pickkers P, Netea MG, van Deuren M, Van der Hoeven JG. Intensive insulin therapy does not alter the inflammatory response in patients undergoing coronary artery bypass grafting: a randomized controlled trial [isrctn95608630]. Crit Care. 2005 ; n° 9(6), R790-R797.33. van Wezel HB, Zuurbier CJ, de Jonge E, et al.. Differential effects of a perioperative hyperinsulinemic normoglycemic clamp on the neurohumoral stress response during coronary artery surgery. J Clin Endocrinol Metab. 2006 ; n° 91(10), pp. 4144-4153.34. He W, Zhang TY, Zhou H, et al.. Impact of intensive insulin therapy on surgical critically ill patients. Zhonghua Wai Ke Za Zhi. 2007 ; n° 45(15), pp. 1052-1054.35. Grey NJ, Perdrizet GA. Reduction of nosocomial infections in the surgical intensive-care unit by strict glycemic control. Endocr Pract. 2004; n° 10 (suppl 2), p. 46-52.36. Bilotta F, Spinelli A, Giovannini F, Doronzio A, Delfini R, Rosa G.. The effect of intensive insulin therapy on infection rate, vasospasm, neurologic outcome, and mortality in neurointensive care unit after intracranial aneurysm clipping in patients with acute subarachnoid hemorrhage: a randomized prospective pilot trial. J Neurosurg Anesthesiol. 2007 ; n° 19(3), pp. 156-160.37. Bilotta F, Caramia R, Cernak I, et al.. Intensive insulin therapy after severe traumatic brain injury: a randomized clinical trial [publié en ligne avant impression le 29 mars 2008]. Neurocrit Care. doi:10.1007 /s12028-008-9084-9.38. Bland DK, Fankhanel Y, Langford E, et al.. Intensive versus modified conventional control of blood glucose level in medical intensive care patients: a pilot study. Am J Crit Care. 2005 ; n° 14(5), pp. 370-376.39. Oksanen T, Skrifvars M, Varpula T, et al.. Strict versus moderate glucose control after resuscitation from ventricular fibrillation. Intensive Care Med. 2007 ; n° 33(12), pp. 2093-2100.40. Benito B, Conget I, Bosch X, et al.. Intensive insulin therapy in non-diabetic patientswith acutemyocardial infarction and hyperglycaemia: INSUCOR study. Med Clin (Barc). 2008 ; n° 130(16), pp. 601-605.41. Davies RR, Newton RW, McNeill GP, Fisher BM, Kesson CM, Pearson D. Metabolic control in diabetic subjects following myocardial infarction: difficulties in improving blood glucose levels by intravenous insulin infusion. Scott Med J. 1991 ; n° 36(3), pp. 74-76.42. Stefanidis A, Melidonis A, Tournis S, et al.. Intensive insulin treatment reduces transient ischaemic episodes during acute coronary events in diabetic patients. Acta Cardiol. 2002 ; n° 57(5), pp. 357-364.43. Walters MR. Weir CJ, Lees KR. A randomised, controlled pilot study to investigate the potential benefit of intervention with insulin in hyperglycaemic acute ischaemic stroke patients. Cerebrovasc Dis. 2006 ; n° 22(2-3), pp. 116-122.44. Gray CS, Hildreth AJ, Sandercock PA, et al.. Glucosepotassium-insulin infusions in the management of poststroke hyperglycaemia: theUK Glucose Insulin in Stroke Trial (GIST-UK). Lancet Neurol. 2007 ; n° 6(5), pp. 397-406.45. Bruno A, Kent TA, Coull BM, et al.. Treatment of hyperglycemia in ischemic stroke (THIS): a randomized pilot trial. Stroke. 2008 ; n° 39(2), pp. 384-389.46. Mitchell I, Knight E, Gissane J, et al.. A phase II randomised controlled trial of intensive insulin therapy in general intensive care patients. Crit Care Resusc. 2006 ; n° 8(4), pp. 289-293.47. De La Rosa GD, Donado JH, Restrepo AH, et al.. Tight glycemic control in patients in mixed intensive care unit (ICU): randomized, clinical trial [abstract]. Intensive Care Med. 2006 ; n° (32), S237.48. Farah R, Samokhvalov A, Zviebel F, Makhoul N.. Insulin therapy of hyperglycemia in intensive care. Isr Med Assoc J. 2007 ; n° 9(3), pp. 140-142.49. McMullin J, Brozek J, McDonald E, et al.. Lowering of glucose in critical care: a randomized pilot trial. J Crit Care. 2007 ; n° 22(2), pp. 112-118.50. Henderson WR, Dhingra VK, Chittock DR, Ronco JJ. Survival using glucose algorithm regulation (sugar) trial–pilot data (in association with the Canadian Critical Care Trials Group) [abstract]. Proc Am Thorac Soc. 2005; n° 2, A37.51. Bellomo R, Egi M.. Glycemic control in the intensive care unit: why we should wait for nice-sugar. Mayo Clin Proc. 2005; n° 80(12), pp. 1546-1548.52. Angus DC, Abraham E. Intensive insulin therapy in critical illness. Am J Respir Crit Care Med. 2005 ; n° 172(11), pp. 1358-1359.53. Schultz MJ, Royakkers AA, Levi M, Moeniralam HS, Spronk PE. Intensive insulin therapy in intensive care: an example of the struggle to implement evidence-based medicine. PLoS Med. 2006 ; n° 3(12), e456.54. Gandhi GY, Nuttall GA, Abel MD, et al.. Intensive intraoperative insulin therapy versus conventional glucose management during cardiac surgery: a randomized trial. Ann Intern Med. 2007 ; n° 146(4), pp. 233-243.55. Malesker MA, Foral PA, McPhillips AC, Christensen KJ, Chang JA, Hilleman DE. An efficiency evaluation of protocols for tight glycemic control in intensive care units. Am J Crit Care. 2007 ; n° 16(6), pp. 589-598.56. Aragon D.. Evaluation of nursing work effort and perceptions about blood glucose testing in tight glycemic control. Am J Crit Care. 2006 ;n° 15(4), pp. 370-377.
ARTICLES EN RAPPORT
Cette semaine dans le JAMA-Français
JAMA. 2008;300:875.
Texte Complet
Contrôle strict de la glycémie chez le patient adulte en état critique
Simon Finfer et Anthony Delaney
JAMA. 2008;300:963-965.
Texte Complet
|