 |
 |

Relation entre le polymorphisme génétique et l’activité fonctionnelle de la paraoxonase-1 (PON1) et le stress oxydatif systémique et le risque cardiovasculaire
Tamali Bhattacharyya, MD, MS;
Stephen J. Nicholls, MBBS, PhD;
Eric J. Topol, MD;
Renliang Zhang, MD, PhD;
Xia Yang, PhD;
David Schmitt, BA;
Xiaoming Fu, MS;
Mingyuan Shao, MS;
Danielle M. Brennan, MS;
Stephen G. Ellis, MD;
Marie-Luise Brennan, PhD;
Hooman Allayee, PhD;
Aldons J. Lusis, PhD;
Stanley L. Hazen, MD, PhD
JAMA. 2008;299(11):1265-1276
RÉSUMÉ
 |  |
Contexte La paraoxonase-1 (PON1) est présentée comme ayant des propriétés anti-oxydantes et cardio-protectrices. Mais la relation entre les génotypes et l’activité fonctionnelle de la PON1 d’une part et les mesures systémiques du stress oxydatif et du risque de maladie cardiovasculaire (MCV) d’autre part n’a pas fait l’objet d’études systématiques chez l’homme.
Objectif Étudier la relation entre les déterminants génétiques et biochimiques de l’activité de PON1 et les mesures systémiques du stress oxydatif et du risque de MCV chez l’homme.
Schéma, environnement et participants L’association entre les mesures de l’activité systémique de la PON1 et un polymorphisme fonctionnel (Q192R) entraînant une forte activité de la PON1 avec une MCV prévalente et des événements indésirables cardiaques majeurs futurs (infarctus du myocarde, accident cérébro-vasculaire ou décès) a été évaluée sur 1399 patients consentants soumis à une angiographie coronarienne entre septembre 2002 et novembre 2003 à la Cleveland Clinic. Ces patients ont été suivis jusqu’en décembre 2006. Les concentrations systémiques de plusieurs produits d’oxydation des acides gras à structure définie ont également été mesurées par spectrométrie de masse sur 150 patients équivalents par l’âge, le sexe et l’appartenance ethnique et comparées en fonction du génotype et de l’activité de la PON1.
Principal critère de jugement Relation entre un polymorphisme fonctionnel et l’activité de la PON1 et les indices globaux de stress oxydatif systémique et du risque de MCV.
Résultats Le génotype PON1 a montré des associations significatives et dose-dépendantes (QQ192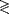 QR192 QR192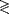 RR192) avec une baisse de l’activité de PON1 sérique et une hausse des indices systémiques de stress oxydatif. Les participants porteurs du génotype QQ192 présentaient un risque accru de mortalité, toutes causes confondues, par rapport à ceux porteurs des génotypes RR192 ou QR192 (43/681 décès [6,75 %] pour RR192 et QR192 vs 62/584 décès [11,1 %] pour QQ192 ; risque relatif ajusté : 2,05 ; intervalle de confiance [IC] 95 % : 1,32-3,18), ainsi que d’événements cardiaques majeurs (88/681 événements [13,6 %] pour RR192 et QR192 vs 102/584 événements [18,0 %] pour QQ192 ; RR ajusté : 1,48 ; IC 95 % : 1,09-2,03 ; p=0,01). L’incidence des événements cardiaques majeurs était significativement plus faible chez les participants appartenant au quartile présentant la plus forte activité de PON1 (23/315 [7,3 %]) et 235/324 [7,7 %] pour la paraoxonase et l’arylestérase respectivement) que chez ceux du quartile inférieur (78/311 [25,1 %] et 75/319 [23,5 %] ; p=0,001 pour la paraoxonase et l’arylestérase respectivement). Les risques relatifs ajustés d’événements cardiaques majeurs entre les quartiles de plus forte et de plus faible activité de la PON1 étaient de 3,4 (IC 95 % : 2,1-5,5 ; p=0,001) pour la paraoxonase et de 2,9 (IC 95 % : 1,8-4,7 ; p=0,001) pour l’arylestérase et restaient indépendants dans l’analyse multivariée. RR192) avec une baisse de l’activité de PON1 sérique et une hausse des indices systémiques de stress oxydatif. Les participants porteurs du génotype QQ192 présentaient un risque accru de mortalité, toutes causes confondues, par rapport à ceux porteurs des génotypes RR192 ou QR192 (43/681 décès [6,75 %] pour RR192 et QR192 vs 62/584 décès [11,1 %] pour QQ192 ; risque relatif ajusté : 2,05 ; intervalle de confiance [IC] 95 % : 1,32-3,18), ainsi que d’événements cardiaques majeurs (88/681 événements [13,6 %] pour RR192 et QR192 vs 102/584 événements [18,0 %] pour QQ192 ; RR ajusté : 1,48 ; IC 95 % : 1,09-2,03 ; p=0,01). L’incidence des événements cardiaques majeurs était significativement plus faible chez les participants appartenant au quartile présentant la plus forte activité de PON1 (23/315 [7,3 %]) et 235/324 [7,7 %] pour la paraoxonase et l’arylestérase respectivement) que chez ceux du quartile inférieur (78/311 [25,1 %] et 75/319 [23,5 %] ; p=0,001 pour la paraoxonase et l’arylestérase respectivement). Les risques relatifs ajustés d’événements cardiaques majeurs entre les quartiles de plus forte et de plus faible activité de la PON1 étaient de 3,4 (IC 95 % : 2,1-5,5 ; p=0,001) pour la paraoxonase et de 2,9 (IC 95 % : 1,8-4,7 ; p=0,001) pour l’arylestérase et restaient indépendants dans l’analyse multivariée.
Conclusion Cette étude apporte une preuve directe d’un lien mécanique entre les déterminants génétiques et l’activité de la PON1 d’une part et le stress oxydatif systémique et le risque cardiovasculaire prospectif de l’autre, ce qui suggère un mécanisme potentiel de fonction athéroprotectrice de la PON1.
Le stress oxydatif systémique favorise une série d’événements clés dans le développement de l’athérosclérose. Les recherches pour identifier des stratégies thérapeutiques anti-oxydantes efficaces présentent un intérêt clinique potentiel. Par exemple, en plus de leur effet sur le transport retour du cholestérol, les lipoprotéines à haute densité (HDL) auraient aussi des effets anti-inflammatoires et antioxydants systémiques. La paraoxonase-1 (PON1) (estérase/lactonase) associée aux HDL contribue à l’activité anti-inflammatoire et anti-oxydante de la lipoprotéine1, bien que ceci n’ait pas encore été mis en évidence directement chez l’homme.
Plusieurs éléments de preuve suggèrent toutefois que la PON1 pourrait promouvoir ces effets anti-oxydants et athéroprotecteurs2,3. La PON1 inhibe l’oxydation de la lipoprotéine de basse densité (LDL) in vitro2,4. La délétion génétique de PON1 est associée à une susceptibilité accrue de la LDL à l’oxydation ex vivo, à une hausse des mesures du stress oxydatif des macrophages et à une augmentation de la taille des lésions d’athérosclérose sur les modèles animaux. Inversement, la surexpression du transgène PON1 humain sur la souris entraîne une réduction des lésions aortiques et une baisse correspondante des épitopes reconnus par les anticorps spécifiques aux adduits lipide-protéine oxydés5-8.
S’il a été prouvé que la PON1 prévient l’athérosclérose chez l’animal, ses propriétés athéroprotectrices et anti-oxydantes restent à établir chez l’homme. Plusieurs études ont suggéré que la PON1 pourrait jouer un rôle athéroprotecteur, mais l’association simultanée entre polymorphismes et activité enzymatique d’une part et risque de maladie cardiovasculaire (MCV) d’autre part n’a été rapportée que dans un petit nombre d’études de cohortes1-3,9-13. Pour compliquer un peu plus cette relation chez l’homme, de multiples polymorphismes de la PON1 ont été découverts, tant au niveau de la région codante de la protéine que de son promoteur, dont certains pourraient influencer le niveau global d’activité systémique14.
Dans une méta-analyse récente de 43 études sur les différents polymorphismes de nucléotide simple (SNP) de la PON1, la variante Q192R s’est imposée comme le génotype le plus intéressant, même si ce SNP n’a montré qu’une faible association globale avec la coronaropathie, avec un degré de significativité non établi15. Toutes les études de la méta-analyse ont toutefois porté sur de petites cohortes de patients, avec une évaluation variable de l’activité fonctionnelle et sans examen quantitatif des indices systémiques du stress oxydatif. Les grandes conclusions de la méta-analyse ont donc mis en avant la nécessité de procéder à des recherches systématiques et à beaucoup plus grande échelle sur le rôle de la PON1 dans les MCV chez l’homme, sachant surtout qu’aucune corrélation significative n’a été notée pour le polymorphisme Q192R dans les grandes études de la méta-analyse et que les études génétiques et fonctionnelles ont comme d’habitude fait défaut15. Il reste donc à établir si les déterminants génétiques et biochimiques de la PON1 sont liés au stress oxydatif et au risque de MCV chez l’homme.
Le polymorphisme Q192R consiste en une mutation de la glutamine (Q, type sauvage) en arginine (R, variant) au niveau de l’acide aminé 192 de la séquence de la protéine. L’activité fonctionnelle de la PON1 peut se mesurer par sa capacité à hydrolyser des substrats exogènes tels que la paraoxone et le phénylacétate, reflet de l’activité de la paraoxonase et de l’arylestérase respectivement. Des différences fonctionnelles ont été observées sur le taux d’hydrolyse des alloenzymes Q192 et R192 avec la paraoxone comme substrat, mais aucune différence n’a été rapportée sur leur capacité à hydrolyser le phénylacétate16.
Dans cette étude clinique à grande échelle, nous avons exploré in vivo le lien mécanique entre le polymorphisme fonctionnel de PON1 Q192R, l’activité de la PON1 dans le sérum à l’aide de doubles mesures de l’activité enzymatique pour tenir compte du taux différencié d’hydrolyse des alloenzymes, des différents indices du stress oxydatif systémique et du risque de MCV prévalente (athérosclérose) comme d’événements cardiovasculaires majeurs à court terme (infarctus du myocarde [MI], accident cérébro-vasculaire et décès).
Méthodologie
Protocole de l’étude et prélèvements
L’activité de la PON1 et les polymorphismes fonctionnels ont été déterminés dans le sérum et sur des prélèvements d’ADN de 1399 patients ayant signé le formulaire de consentement éclairé et ayant participé à l’étude de la GeneBank entre septembre 2002 et novembre 2003. La GeneBank est une banque d’échantillons à site unique (Cleveland Clinic, Cleveland, Ohio) constituée à partir de patients soumis à une angiographie coronarienne faite à titre diagnostic avec caractérisation approfondie clinique et biochimique et observation longitudinale.
Pour les mesures systémiques du stress oxydatif, le sang total prélevé dans des tubes EDTA a été immédiatement mis en rotation, le plasma et la couche leucocyto-plaquettaire ont été isolés, le plasma a été stocké en atmosphère d’argon avec supplémentation de cocktail antioxydant, comme précédemment décrit17. Le sérum destiné aux mesures de l’activité de la PON1 a été obtenu dans des tubes avec gel séparateur 30 à 60 minutes après coagulation à température ambiante. Tous les échantillons ont été stockés à -80 °C jusqu’à l’analyse. Les patients ont été suivis une fois par an jusqu’au 14 décembre 2006 pour évaluer l’incidence d’événements cardiaques majeurs et de décès. L’étude GeneBank a été approuvée par le comité d’éthique de la Cleveland Clinic. Tous les patients ont signé le formulaire de consentement éclairé avant leur recrutement dans l’étude.
Diagnostic clinique et définition des résultats
Les données sur le profil démographique, les antécédents médicaux et les traitements pris ont été recueillies lors d’un entretien avec le patient et confirmées par examen de leur dossier. Les données sur l’appartenance ethnique étaient spécifiées avant l’étude et obtenues par auto-déclaration. Tous les résultats cliniques ont été vérifiés par documentation des sources. La mortalité a été évaluée à l’aide du registre des décès de la Sécurité sociale18.
La maladie cardiovasculaire était définie comme la présence d’une coronaropathie ou artériopathie périphérique. Les coronaropathies comprenaient le diagnostic établi d’une angine de poitrine, stable ou instable, d’un infarctus du myocarde (d’après électrocardiogramme ou élévation des enzymes cardiaques), ou confirmation angiographique d’une sténose 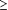 50 % sur un ou plusieurs vaisseaux épicardiques. L’artériopathie périphérique était définie comme la présence de toute athérosclérose extra-coronarienne et comprenait la maladie obstructive (dont épisode de claudication intermittente), l’amaurose fugace, l’accident vasculaire cérébral ou les signes de sténose artérielle ou de maladie anévrysmale au niveau des membres thoraciques ou de l’aorte abdominale par échocardiographie Doppler. 50 % sur un ou plusieurs vaisseaux épicardiques. L’artériopathie périphérique était définie comme la présence de toute athérosclérose extra-coronarienne et comprenait la maladie obstructive (dont épisode de claudication intermittente), l’amaurose fugace, l’accident vasculaire cérébral ou les signes de sténose artérielle ou de maladie anévrysmale au niveau des membres thoraciques ou de l’aorte abdominale par échocardiographie Doppler.
Le risque prospectif cardiovasculaire était évalué à partir de l’incidence d’événements cardiovasculaires majeurs : IM fatal et non fatal, accident vasculaire cérébral fatal et non fatal et décès (toutes causes confondues). Les événements non fatals étaient définis comme un IM ou un AVC chez des patients ayant survécu au moins 48 heures à partir de l’apparition des symptômes. Nous avons également évalué le risque d’incidence vraie de nouvel événement cardiovasculaire chez les participants sans antécédents de MCV à leur recrutement (entrée dans l’étude) et le risque d’événements cardiovasculaires récurrents chez les participants présentant un diagnostic établi de MCV à l’entrée dans l’étude en fonction du degré d’activité de la PON1.
Détermination de l’activité de la PON1
L’activité de l’arylestérase et de la paraoxonase sériques a été mesurée de façon indépendante par spectrophotométrie UV sur plaque 96 puits (Spectramax 384 Plus, Molecular Devices, Sunnyvale, Californie) avec le phénylacétate ou la paraoxone (Sigma-Aldrich, St Louis, Missouri) comme substrats respectifs19. Pour les tests sur l’arylestérase, les premiers taux d’hydrolyse étaient déterminés à 270 nm sur du sérum dilué au 1/50e (final) dans des mélanges réactionnels composés de 3,4 mM phénylacétate, 9 mM Tris hydrocholoride (pH 8) et 0,9 mM chlorure de calcium à 24 °C. Un coefficient d’extinction (à 270 nm) de 1310 M–1·cm–1 a été utilisé pour calculer les unités d’activité de l’arylestérase, exprimée par la quantité de phénylacétate hydrolysé en micromoles par minute et ml de sérum.
Pour les tests sur l’activité de la paraoxonase, le taux de génération de para-nitrophénol a été déterminé à 405 nm sur du sérum dilué au 1/40e (final) dans des mélanges réactionnels composés de 1,5 mM paraoxone, 10 mM Tris hydrocholoride (pH 8), 1 M chlorure de sodium et 2 mM chlorure de calcium à 24 °C. Un coefficient d’extinction (à 405 nm) de 17 000 M–1·cm–1 été utilisé pour calculer les unités d’activité de la paraoxonase, exprimée par la quantité de para-nitrophénol produit en nanomoles par minute et millilitre de sérum.
Les tests sur la paraoxonase et l’arylestérase ont été effectués en double et la moyenne de l’activité enzymatique a été calculée sur chaque échantillon. Chaque plaque 96 puits comprenait un contrôle négatif pour évaluer l’hydrolyse spontanée des substrats ainsi que des aliquots de sérum de trois calibreurs poolés ayant un degré d’activité connu (faible, moyen ou élevé) afin d’assurer la qualité du test d’après les critères d’acceptabilité établis. Les coefficients de variance intra- et inter-tests pour la performance de l’arylestérase étaient de 1,2 et 3,9 % respectivement et de 2,0 et 5,6 % pour l’activité de la paraoxonase (20 mesures effectuées sur 10 jours différents).
Pour établir les valeurs normales, l’activité de l’arylestérase et de la paraoxonase sériques a également été déterminée sur 100 volontaires apparemment sains (50 hommes et 50 femmes) âgés de 55 ans et plus (moyenne 64 ans [écart-type=4]) recrutés sur annonce dans la presse locale. Dans cette population saine d’âge moyen, l’activité systémique de l’arylestérase était comprise entre 169,3 et 814,0 µmol/min/mL, avec une valeur médiane de 605,8 µmol/min/mL de sérum (IIQ : 517,6-666,8 µmol/min/mL). L’activité systémique de la paraoxonase sur cette population saine d’âge moyen était comprise entre 436,4 et 4025 nmol/min/mL (médiane : 1264 nmol/min/mL, IIQ : 647,0-1865 nmol/min/mL).
Génotypage
Sur les 1399 participants, 1386 échantillons d’ADN tirés de la cohorte GeneBank étaient disponibles pour le génotypage du polymorphisme Q192R PON1 (SNP rs662). Les amorces pour l’amplification des séquences contenant le SNP ont été conçues à l’aide de Primer 3 (http://www.genome.wi.mit.edu/cgi-bin/primer/primer3_www.cgi). Les sondes sens et antisens utilisées pour la polarisation de fluorescence (détection du SNP par extension d’une seule base) ont été conçues à l’aide de Primer PREMIER (PREMIER Biosoft International, Palo Alto, Californie). Chaque réaction de génotypage consistait en une PCR monoplex suivie d’une extension d’une seule paire de bases à l’aide d’une sonde sens ou antisens et de didéoxynucléotides marqués par TAMRA ou R110 pour les allèles alternatifs. Le signal de fluorescence était détecté par polarisation à l’aide de l’analyste HT (Molecular Devices) et les génotypes étaient déterminés à partir des valeurs du signal TAMRA ou R110.
Spectrométrie de masse
Les concentrations plasmatiques d’espèces à structure spécifique d’acides hydroxyeicosatétraénoïques (HETE), acides hydroxyoctadécadiénoïques (HODE), 8-isoprostane prostaglandine F2 (8-isoPGF2 (8-isoPGF2 ) et de leurs acides gras précurseurs (acides arachidoniques ou linoléïques) étaient quantifiées sur les échantillons des participants à l’aide de la chromatographie en phase liquide à haute performance avec dilution isotopique stable et de la spectrométrie de masse en tandem avec ionisation par électrospray en ligne. La prostaglandine F2 ) et de leurs acides gras précurseurs (acides arachidoniques ou linoléïques) étaient quantifiées sur les échantillons des participants à l’aide de la chromatographie en phase liquide à haute performance avec dilution isotopique stable et de la spectrométrie de masse en tandem avec ionisation par électrospray en ligne. La prostaglandine F2 -d4 (Cayman Chemicals, Ann Arbor, Michigan) était utilisée comme norme interne pour le calibrage de la 8-isoPGF2 -d4 (Cayman Chemicals, Ann Arbor, Michigan) était utilisée comme norme interne pour le calibrage de la 8-isoPGF2 et le 15-HETE-d8 (Cayman Chemicals) pour les autres acides gras oxydés. La quantification des concentrations plasmatiques totales de chaque substance (libre et estérifiée) était effectuée après addition de la norme interne appropriée isotopiquement marquée et hydrolyse catalysée par une base, comme précédemment décrit17. et le 15-HETE-d8 (Cayman Chemicals) pour les autres acides gras oxydés. La quantification des concentrations plasmatiques totales de chaque substance (libre et estérifiée) était effectuée après addition de la norme interne appropriée isotopiquement marquée et hydrolyse catalysée par une base, comme précédemment décrit17.
Des analyses pour chaque génotype (QQ192, QR192 et RR192) ont été effectuées sur les échantillons de plasma recueillis sur 50 participants équivalents par l’âge, le sexe et l’appartenance ethnique et sélectionnés au hasard parmi les 1386 patients. Pour éviter tout biais statistique, 50 participants porteurs du génotype le plus rare dans notre cohorte (RR192) ont d’abord été sélectionnés au hasard sur les 136 participants porteurs au total (50 % d’hommes ; 100 % de Blancs ; âge moyen : 63 ans [ET=2]). Puis 50 autres participants porteurs de QQ192 et QR192 ont été sélectionnés de façon à correspondre au groupe QQ192 par l’âge, le sexe et l’appartenance ethnique en vue des analyses par spectrométrie de masse.
Analyses statistiques
Le diagnostic clinique, la définition des résultats, la détermination de l’activité de la PON1, le génotypage et les analyses de spectrométrie de masse ont toutes été effectuées par des investigateurs ignorant le statut du patient en termes de MCV et d’autres paramètres. Les variables continues sont présentées en tant que moyenne (avec écart-type, ET) ou médiane (avec intervalle interquartile, IIQ) pour les données non distribuées normalement et les variables catégoriques, en valeur absolue ou pourcentages. L’analyse de régression a été utilisée pour calculer la variance (R2) due au polymorphisme de la PON1 et aux mesures de son activité. Le seuil des quartiles a été déterminé à partir des degrés d’activité enzymatique des 1399 participants au moment de leur entrée dans l’étude. L’analyse de la variance ou test de Kruskal-Wallis (pour les données non distribuées normalement) a été utilisée pour évaluer la différence des niveaux moyens d’acides gras oxydés selon le génotype de PON1 et les tertiles de l’activité de la PON1.
La méthode de Kaplan-Meier a été utilisée pour tracer les courbes représentant les événements dans le temps pour les quartiles et génotypes liées à l’activité de la PON1 et un test logarithmique par rangs a été effectué pour évaluer les différences entre les courbes.
L’analyse de régression logistique a été utilisée pour calculer les rapports de cotes (rapport de cotes, OR) ajustés pour l’association entre les degrés d’activité et le statut de MCV prévalent après ajustement des facteurs de risque traditionnels et de certaines classes de médicaments (statines et aspirine).
Le modèle de Cox (régression à effet proportionnel) a été appliqué pour déterminer si la PON1 est un prédicteur indépendant des événements cardiaques à venir. Le risque relatif (RR) non ajusté d’événements cliniques a été calculé en référence au quartile supérieur (correspondant au risque le plus faible). Les modèles ont été ajustés pour tous les facteurs de risque cardiaque traditionnels : score de risque selon Framingham ATP-III (tenant compte du diabète), concentration log de protéine C réactive, indice de masse corporelle et prise de médicaments (statines et aspirine). Des modèles ont été créés séparément pour la paraoxonase et l’arylestérase. Toutes les variables utilisées dans ces modèles étaient conformes au modèle de régression à effet proportionnel, étant testées en tant que covariables à dépendance chronologique dans le modèle multivarié.
Des courbes ROC ont été tracées pour estimer l’indice C pour les événements cardiovasculaires majeurs avec et sans l’activité de la PON1 en tant que prédicteur20. L’indice C est analogue à l’aire sous la courbe ROC, mais tient compte de la censure à droite21. Pour évaluer le rôle de l’activité de la PON1 en tant que marqueur prédictif, nous avons calculé les indices de concordance22 avec et sans chaque mesure de l’activité de la PON1 dans des modèles multivariés séparés incluant les variables décrites ici. L’amélioration de la prédictibilité avec l’ajout de chacun de ces facteurs de risque bien établis a été évaluée par la différence entre les indices de concordance23. La différence des indices a été corrigée de tout biais et nous avons eu recours au bootstrap pour générer les intervalles de confiance (IC) 95 %. Un test t sur un échantillon a été effectué pour déterminer si la différence était égale à zéro.
Le risque d’événements cliniques a été calculé pour les participants présentant le polymorphisme PON1 Q192R, puis ajusté après contrôle des différences en termes de facteurs de risque traditionnels et de prise de médicaments (v. plus haut). Un modèle d’héritage supplémentaire a également été créé pour évaluer l’évolution du risque de présenter une et deux copies de l’allèle Q. Les génotypes se sont vu attribuer les valeurs de 0, 1 et 2 avant d’être intégrés à un modèle de Cox. Toute les analyses statistiques ont été effectuées à l’aide du logiciel SPSS, version 11 (SPSS, Chicago, Illinois) et vérifiées sur SAS, version 8.2 (SAS Institute, Cary, Caroline du Nord). Toutes les valeurs p sont bilatérales, le seuil de significativité étant fixé à p=0,05.
Résultats
Données cliniques, biochimiques et démographiques
Les caractéristiques cliniques des participants stratifiées selon diagnostic de MCV au moment de l’entrée dans l’étude sont présentées en résumé dans le TABLEAU 1. Les participants atteints de MCV étaient plus âgés et présentaient une plus forte prévalence d’antécédents d’hyperlipidémie, de diabète et d’hypertension ainsi qu’une prise plus importante d’aspirine et de statines. Si 66 % des patients prenaient des statines, moins de 10 % de la cohorte prenaient des fénofibrates. Les participants atteints de MCV présentaient des concentrations plus faibles de cholestérol HDL et LDL (probablement du fait de la prise de statines) et des concentrations plus fortes de triglycérides de protéine C réactive.
|
|

|
|
Tableau 1. Caractéristiques basales et événements prospectifs chez les participants soumis à une cathétérisation cardiaque diagnostique (N = 1399)
|
|
|
Sur la cohorte dans son ensemble, 46,3 % (642/1386) présentaient le génotype QQ192, 43,9 % (608/1386) étaient porteurs de QR192 et 9,8 % (136/1386) de RR192. Les participants de type caucasien se distinguaient par un génotype QQ192 plus fréquent (621/1254 [49,5 %] vs 17/126 [13,5 %] ; p=0,001) et un génotype RR192 moins fréquent (92/1254 [7,4 %] vs 44/126 [34,9 %] ; p=0,001) que chez les autres.
Quelle que soit l’appartenance ethnique, l’activité de la paraoxonase et de l’arylestérase était significativement plus faible chez les participants atteints de MCV que chez les autres : pour la paraoxonase, la médiane était de 860,6 (IIQ : 442,6-1599) nmol/min/mL vs 1164 (IIQ : 473,5-1825) nmol/min/ml (p=0,001) et pour l’arylestérase, de 334,6 (IIQ : 279,5-395,8) µmol/min/mL vs 356,9 (IIQ : 296-424,4) µmol/min/ml (p=0,001) (TABLEAU 1). De même, les degrés systémiques d’activité de la paraoxonase et de l’arylestérase sériques étaient plus faibles chez les participants atteints de MCV que chez les volontaires sains d’âge moyen : pour la paraoxonase, la médiane était de 860,6 (IIQ : 442,6-1599) nmol/min/mL vs 1264 (IIQ : 647,0-1864,6) nmol/min/mL (p=0,001) et pour l’arylestérase, de 334,6 (IIQ : 279,5-395,8) µmol/min/mL vs 605,8 (IIQ : 517,6-666,8) µmol/min/ml (p=0,001).
Au cours du suivi (moyenne : 44 mois [ET=7] ; minimum : 3 ans), 13,8% des participants (193/1399) ont connu au moins un événement cardiovasculaire majeur (décès : 7,6 % [106/1399] ; IM non fatal : 5,7% [80/1399] et AVC : 1,1 % [16/1399]).
Génotype PON1 et activité de la paraoxonase
Le TABLEAU 2 résume les liens entre les génotypes PON1 Q192R et l’activité paraoxonase pour l’ensemble de la population de l’étude. Le polymorphisme PON1 Q192R répond à la loi d’équilibre de Hardy-Weinberg. L’activité paraoxonase était significativement plus faible chez les participants avec le génotype QQ192 que chez les participants avec le génotype QR192 (médiane : 453,5 [IIQ : 360,4-560,3] nmol/min/mL vs 1436 [IIQ : 1129-1800] nmol/min/mL; P< 0,001), ou avec le génotype RR192 (médiane : 453,5 [IIQ : 360,4-560,3] nmol/min/mL vs 2374 [IIQ : 1978-2851] nmol/min/mL; P<0,001) (TABLEAU 2).
|
|

|
|
Tableau 2. Distribution des quartiles d’activité paroxonase dans chaque génotype PON1 Q192R
|
|
|
Tandis que 49,4% des participants avec le type sauvage du génotype QQ192 (317/642) se situaient dans le quartile inférieur de l’activité PON1, seul 4,4% des participants porteurs du génotype variant RR192 (6/136) se situaient dans le quartile d’activité inférieur. Par contre, 3,9% des participants porteurs du génotype QQ192 (25/642) et 83,8% porteurs du génotype RR192 (114/136) se situaient dans le quartile d’activité supérieur (TABLEAU 2).
Dans le quartile d’activité inférieur, 92,2% des participants de l’étude (317/344) étaient porteurs du génotype QQ192, et seulement 1,7% (6/344) possédaient le génotype RR192. Une tendance inverse a été observée dans le quartile d’activité supérieur, avec 7,2% des participants (25/348) possédant le génotype QQ192 et 32,8% (114/348) possédant le génotype RR192 (TABLEAU 3). L’analyse de la régression a confirmé que le polymorphisme PON1 Q192R représentait 58,5% (R2=0,585; P<0,001) de la variation de l’activité de la paraoxonase sérique dans la population de l’étude.
|
|

|
|
Tableau 3. Distribution des génotypes PON1 Q192R dans chaque quartile d'activité paroxonase
|
|
|
Génotype PON1, activité paraoxonase, et stress oxydatif systémique
Les concentrations plasmatiques de nombreux acides gras oxydés à structure spécifique ont été quantifiées chez les participants, avant d’analyser le lien avec le génotype PON1 (TABLEAU 4) et avec l’activité paraoxonase (TABLEAU 4). Tous les indices systémiques du stress oxydatif mesurés étaient plus faibles chez les participants possédant le génotype RR192 que chez les participants possédant le génotype QQ192 appariés en fonction de l’âge, du sexe et de la race (P<0,001 pour toutes les comparaisons). De la même manière, une corrélation inverse proportionnelle à la dose a été mise en évidence entre les taux d’activité de la paraoxonase sérique et de multiples indices systémiques directs du stress oxydatif (TABLEAU 4). Ces résultats confirment la base génétique et biochimique de l’hypothèse selon laquelle le variant PON1 Q192R influence de manière importante les mesures quantitatives du stress oxydatif systémique chez l’homme.
|
|

|
|
Tableau 4. Taux plasmatiques totaux d'acides gras oxydés en fonction du génotype PON1 Q192R et du tertile d'activité paroxonase dans le sérum
|
|
|
Association entre le polymorphisme PON1 Q192R et la prévalence de MCV et son issue
Le génotype PON1 QQ192 était plus fréquent parmi les patients atteints de coronaropathie que parmi les participants sans coronaropathie, respectivement 461/962 (47,9%) vs. 169/405 (41,7%) (P=0,04). À l’inverse, la présence du génotype PON1 RR192 était associée à une prévalence plus faible de la coronaropathie (TABLEAU 5). De la même manière, les participants porteurs du génotype PON1 QQ192 avaient aussi une probabilité plus élevée d’avoir des antécédents de pontage coronarien (P=0,03), et une tendance accrue à des antécédents d’angioplastie coronaire percutanée (P=0,09) (données non présentées). La présence du génotype PON1 RR192 était associée aux tendances opposées (moins d’antécédents de revascularisation; P=0,09) (données non présentées). Aucune différence n’a été observée en ce qui concerne la prévalence de l’artériopathie périphérique chez les individus porteurs du génotype PON1 QR192 inclus dans cette cohorte (TABLEAU 5).
|
|

|
|
Tableau 5. Prévalence des maladies par génotype PON1 Q192R
|
|
|
Les données du suivi ont été recueillies pour 1265 participants sur les 1386 dont le génotype était connu (génotype QQ192 : n = 584 ; génotype QR192 : n=563; et génotype RR192 : n=118). Une association significative a été mise en évidence entre le polymorphisme fonctionnel PON1 Q192R et les issues de MCV chez ces patients. Par exemple, la fréquence de toutes les issues cardiovasculaires indésirables observées était significativement plus faible chez les patients porteurs d’un allèle R.
Les estimations de Kaplan-Meier pour la mortalité toutes causes confondues et pour les événements cardiovasculaires indésirables majeurs (ECIM) ont mis en évidence une tendance significative chez les participants de l’étude. Les taux de mortalité toutes causes confondues étaient significativement plus faibles chez les participants homozygotes et hétérozygotes (génotypes RR192 et QR192) (43/681 ; estimation de Kaplan-Meier : 6,75%) que chez les participants avec le génotype QQ192 (62/584 ; estimation de Kaplan-Meier : 11,10%) (P=0,006). De la même manière, les taux d’ECIM au cours des 3 années de suivi étaient plus faibles chez les participants avec les génotypes RR192 et QR192 (88/681 ; estimation de Kaplan-Meier : 13,6%) que chez les individus avec le génotype QQ192 (102/584 ; estimation de Kaplan-Meier : 18,0%) (P=0,03) (TABLEAU 6 et FIGURE).
|
|

|
|
Tableau 6. Relation entre le génotype PON1 Q192R et l'issue des MCV
|
|
|
|
|

|
|
Figure. Relation entre les indices fonctionnels génétiques et biochimiques de l’activité PON1 et risque incident cardiovasculaire
Les génotypes de paraoxonase 1 (PON1) Q192R sont les suivants: RR192 (mutant homozygote) ; QR192 (hétérozygote) ; et QQ192 (type sauvage). Dans les panels supérieurs, les log-rank des valeurs de P sont montrés pour le génotype à-risque QQ192 vs RR192+QR192. L’activité (paraoxonase et arylestérase) a été été classée par catégorie dans des quartiles ; Q1: quartile d’activité la plus basse; Q4: quartile d’activité la plus élevée. For la paraoxonase, Q4>1640, Q3=1640-899.1, Q2=899-450, et Q1>450 nmol/min/ml. Pour l’arylestérase, Q4>403.9, Q3=403.9-338.5, Q2=338.4-283, et Q1>283 µmol/min/ml. Dans les panels moyens et inférieurs, les log-rank des valeurs de P dans les quartiles d'activité sont montrés. Les jours indiquent le nombre de jours depuis l’inclusion au premier événement cardiaque. Les taux d'événement ont été calculés à intervalles de six mois. Les échelles de l’axe Y en bleu indiquent les extrêmes de 0% à 15%. IDM correspond à infarctus du myocarde; AVC, accident vasculaire cérébral.
|
|
|
Dans un modèle à plusieurs variables, dont l’âge, le score de risque selon Framingham ATP-III, la race, la concentration log de protéine C réactive, l’indice de masse corporelle, et l’utilisation de médicaments (statines et aspirine), l’introduction du facteur de risque allèle Q192 n’a mis en évidence aucun lien avec les nouveaux cas d’infarctus du myocarde et d’AVC survenus au cours des trois années suivant l’inclusion dans l’étude. Par contre, une association significative a été observée entre la présence de l’allèle Q192 et une probabilité accrue de décès et d’ECIM (TABLEAU 6). Comparés aux participants avec le génotype RR192 ou le génotype QR192, les individus avec le génotype QQ192 avaient un RR ajusté de 2,05 (IC à 95% : 1,32-3,18) pour la mortalité toutes causes confondues (P=0,001). Par ailleurs, la probabilité d’ECIM au cours des trois années de suivi était aussi plus élevée chez les participants avec le génotype QQ192 que chez les participants avec le génotype RR192 ou le génotype QR192 (RR ajusté : 1,48; IC à 95% : 1,09-2,03; P=0,01) (TABLEAU 6).
Dans des analyses séparées, un modèle d’hérédité additive a été créé pour évaluer la modification du risque associée à la présence d’une copie de l’allèle Q. La présence d’un allèle Q était associée à un RR ajusté de mortalité toutes causes confondues sur les 3 années de suivi égal à 1,58 (IC à 95% : 1,12-2,24; P=0,01). Par ailleurs, dans ce modèle, la présence d’un allèle Q était aussi associée à un risque accru d’ECIM au cours des trois années de suivi (RR : 1,32; IC à 95% : 1,04-1,69; P=0,03).
Association entre l’activité PON1 et la prévalence de MCV et son issue
La prévalence de MCV était plus élevée chez les patients avec une activité sérique faible pour la paraoxonase ou l’arylestérase. Après un ajustement pour les différences dans les facteurs de risque connus de MCV, cette association n’était pas significative pour la paraoxonase (OR : 1,5; IC à 95% : 0,97-2,2; P=0,07 pour la comparaison entre les quartiles supérieur et inférieur), mais elle était significative pour l’arylestérase (OR : 2,1; IC à 95% : 1,4-3,1; P=0,001). Une association significative a été mise en évidence entre les taux d’activité enzymatique sérique faibles et la présence de coronaropathie, tant pour la paraoxonase (OR : 1,5 ; IC à 95% : 1,03-2,3; P=0,03), que pour l’arylestérase (OR : 2,0; IC à 95% : 1,4-3,1; P=0,001). La même tendance a été observée pour l’association entre l’artériopathie périphérique et la paraoxonase (OR : 1,4; IC à 95% : 0,9-2,0; P=0,11), et l’arylestérase (OR : 1,2; IC à 95% : 1,0-2,11; P=0,05).
Les taux de tous les événements cardiovasculaires prospectifs étaient significativement plus faibles chez les participants se situant dans le quartile supérieur de l’activité PON1 que chez les participants dans le quartile inférieur (P<0,001 pour toutes les comparaisons des événements prospectifs) (TABLEAU 7 et FIGURE). La fréquence des nouveaux cas d’infarctus du myocarde ou d’AVC non fatal survenus pendant l’étude parmi les participants se situant dans les quartiles supérieurs de l’activité PON1 était égale à 2,5% (8/315) pour l’activité paraoxonase, et 2,8% (9/324) pour l’activité arylestérase.
|
|

|
|
Tableau 7. Risque d'événements MCV prospectifs en relation avec l'activité PON1 sur toute la cohorte
|
|
|
Les nombres de nouveaux cas d’infarctus du myocarde ou d’AVC non fatal étaient plus élevés parmi les participants se situant dans le quartile inférieur de l’activité paraoxonase (37/311 [11,9%]) et de l’activité arylestérase (40/319 [12,5%]). De la même manière, la fréquence de la mortalité toutes causes confondues au cours des 3 années de suivi était plus faible chez les participants se situant dans les quartiles supérieurs de l’activité paraoxonase (17/315 [5,4%]) et de l’activité arylestérase (16/324 [4,9%]) que chez les participants se situant dans les quartiles inférieurs de l’activité paraoxonase (37/311 [11,9%]) et de l’activité arylestérase (41/319 [12,9%]). Les taux d’ECIM étaient aussi plus faibles chez les participants dans les quartiles supérieurs de l’activité paraoxonase (23/315 [7,3%]) et de l’activité arylestérase (25/324 [7.7%]) que chez les participants dans les quartiles inférieurs de l’activité paraoxonase (78/311 [25,1%]) et de l’activité arylestérase (75/319 [23,5%]) (TABLEAU 7 et FIGURE).
Après l’analyse multivariée, les mesures de l’activité PON1 sérique sont restées liées de manière indépendante avec le risque prospectif d’événements cardiaques (TABLEAU 7). Le risque de nouveaux cas d’infarctus du myocarde ou d’AVC non fatal était plus élevé pour les patients dans les quartiles inférieurs de l’activité paraoxonase (RR : 4,4 ; IC à 95% : 2,0-9,6; P<0,001), et de l’activité arylestérase (RR : 4,5; IC à 95% : 2,2-9,4; P<0,001) au cours des trois années de suivi. Le risque de mortalité toutes causes confondues était aussi le plus élevé chez les participants dans les quartiles inférieurs de l’activité paraoxonase (RR : 2,4; IC à 95% : 1,3-4,4; P=0,004), ou de l’activité arylestérase (RR : 2,2; IC à 95% : 1,2-4,2; P=0,01). Ceci se traduit par une incidence plus élevée d’ECIM parmi les participants dans les quartiles inférieurs de l’activité paraoxonase (RR : 3.4; IC à 95% : 2,1-5,5 ; P< 0,001), et de l’activité arylestérase (RR : 2,9; IC à 95% : 1,8-4,7; P=0,001).
Des analyses complémentaires ont montré que les taux d’activité arylestérase systémique faibles étaient associés à un risque accru de nouvel événement cardiovasculaire (incidence vraie) parmi les participants sans antécédents de MCV ni confirmation angiographique d’une coronaropathie significative (définie par la présence d’une sténose 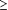 50%) au moment de leur inclusion dans l’étude (RR ajusté : 5,8 ; IC à 95% : 1,2-28,6; P< 0,03) (TABLEAU 8). Le risque d’infarctus du myocarde ou d’AVC non fatal récurrent, de mortalité toutes causes confondues, et d’ECIM récurrent était plus élevé chez les participants avec des valeurs faibles pour l’activité paraoxonase et l’activité arylestérase et un diagnostic confirmé de MCV au moment de leur inclusion dans l’étude (TABLEAU 9). Le RR ajusté d’infarctus du myocarde ou d’AVC non fatal récurrent était égal à 4,5 (IC à 95% : 1,9-11,0; P=0,001) pour la paraoxonase, et 4,2 (IC à 95% : 1,9-9,6; P=0,001) pour l’arylestérase entre les quartiles d’activité supérieur et inférieur. La probabilité d’ECIM récurrent était plus élevée chez les participants se situant dans le quartile d’activité inférieur que chez les participants se situant dans le quartile d’activité supérieur, que ce soit pour la paraoxonase (RR : 3,4; IC à 95% : 2,0-5,9; P<0,001), ou pour l’arylestérase (RR : 2.4; IC à 95% : 1.4-3,9; P=0,001). 50%) au moment de leur inclusion dans l’étude (RR ajusté : 5,8 ; IC à 95% : 1,2-28,6; P< 0,03) (TABLEAU 8). Le risque d’infarctus du myocarde ou d’AVC non fatal récurrent, de mortalité toutes causes confondues, et d’ECIM récurrent était plus élevé chez les participants avec des valeurs faibles pour l’activité paraoxonase et l’activité arylestérase et un diagnostic confirmé de MCV au moment de leur inclusion dans l’étude (TABLEAU 9). Le RR ajusté d’infarctus du myocarde ou d’AVC non fatal récurrent était égal à 4,5 (IC à 95% : 1,9-11,0; P=0,001) pour la paraoxonase, et 4,2 (IC à 95% : 1,9-9,6; P=0,001) pour l’arylestérase entre les quartiles d’activité supérieur et inférieur. La probabilité d’ECIM récurrent était plus élevée chez les participants se situant dans le quartile d’activité inférieur que chez les participants se situant dans le quartile d’activité supérieur, que ce soit pour la paraoxonase (RR : 3,4; IC à 95% : 2,0-5,9; P<0,001), ou pour l’arylestérase (RR : 2.4; IC à 95% : 1.4-3,9; P=0,001).
|
|

|
|
Tableau 8. Incidence du premier événement MCV en relation avec l'activité PON1 chez les patients sans MCV à la visite basale
|
|
|
|
|

|
|
Tableau 9. Risque d'événements MCV récurrents en relation avec l'activité PON1 chez les patients avec MCV à la visite basale
|
|
|
Valeur pronostique de PON1
L'index C pour les critères IDM non mortel et AVC au cours d'une période de trois ans minimum de suivi a été de 0.59 (avec les facteurs de risque traditionnels comme facteurs prédictifs), et a significativement grimpé jusqu'à 0.66 (P=0.007) ou à 0.69 (P=0.001) en comparaison avec les facteurs de risque traditionnels en incluant les mesures systémiques d'activité de la paraoxonase ou de l’arylestérase, respectivement. Pour le critère composite MACE, l'addition de l'activité de la paraoxonase ou de l’arylestérase aux facteurs de risque traditionnels a également augmenté de manière significative la valeur prédictive du modèle pendant une moyenne de 44 (écart-type, 7) mois. Par exemple, l'index C de 0.67 avec les seuls facteurs de risque traditionnels a augmenté jusqu'à 0.71 (P=0.007) et à 0.70 (P=0.01) pour les facteurs de risque plus la paraoxonase ou l'arylestérase, respectivement.
COMMENTAIRE
On pense que le stress oxydatif pourrait jouer un rôle pivot dans la pathogénie d'un certain nombre de processus chroniques de la maladie inflammatoire, y compris l'athérosclérose. L’échec des études de supplémentation par  -tocophérol qui aurait des propriétés anti-oxydantes préventives des événements cardio-vasculaires a introduit l'hypothèse de l’oxydation dans l’athérosclérose.24 Par conséquent, la recherche continue à identifier des stratégies efficaces qui favorisent les effets antioxydants systémiques chez l'homme et à déterminer s'ils ont une influence bénéfique sur le taux de MCV. -tocophérol qui aurait des propriétés anti-oxydantes préventives des événements cardio-vasculaires a introduit l'hypothèse de l’oxydation dans l’athérosclérose.24 Par conséquent, la recherche continue à identifier des stratégies efficaces qui favorisent les effets antioxydants systémiques chez l'homme et à déterminer s'ils ont une influence bénéfique sur le taux de MCV.
Les études génétiques et biochimiques actuelles démontrent que la protéine PON1 associée au HDL stimule des effets antioxydants systémiques prononcés chez l'homme, avec des liens coïncidents à la réduction de la prévalence de la maladie coronarienne et aux risques prospectifs de MACE. Nos résultats démontrent que le polymorphisme PON1 Q192R et l’activité PON1 sérique sont associés à la prévalence de la maladie coronarienne et à l’incidence des événements cardio-vasculaires défavorables.
Il a été émis l’hypothèse que PON1 contribuait à la propriété athéroprotectrice de HDL par l'intermédiaire de la promotion d'un effet antioxydant systémique.1,25 Cependant, il n’y a pas in vivo de preuve définitive des effets antioxydants systémiques que PON1 pourrait stimuler chez l'homme. Une méta-analyse récente de 43 études examinant le rapport entre PON1 et les résultats cliniques15 a conclu qu’une incertitude considérable demeure, puisque les études publiées à ce jour impliquent principalement de petites cohortes de participants. D'ailleurs, elles n'ont souvent pas simultanément examiné le génotype PON1, les mesures systémiques de l’activité PON1, et les résultats cardio-vasculaires, et aucune n'a examiné les indices quantitatifs du stress systémique oxydatif.
Dans cette étude, nous avons étudié le rapport potentiel entre l’activité PON1, le génotype PON1, le stress oxydatif systémique, et la maladie coronarienne et des artères périphériques dans une grande, cohorte prospective de patients pour évaluer plus complètement les rapports mentionnés ci-dessus. Nous démontrons que le polymorphisme PON1 Q192R est fonctionnel, ayant pour résultat une activité enzymatique accrue. En parallèle, nous démontrons que les niveaux systémiques élevés de produits d'oxydation multiples d’acides gras structurellement distincts augmentés dans la plaque athéroscléreuse et le plasma des participants ayant une MCV26,27 sont associés à des niveaux systémiques bas de l’activité PON1 et du génotype PON1 QQ192. D'une manière primordiale, les échantillons de plasma analysés dans la présente étude ont été recueillis et traités dans des conditions conçues pour prévenir une oxydation artificielle des lipides pendant le stockage et l'analyse. La constatation que les niveaux de 9-HETE, un isomère de l’oxydation de l’acide arachidonique, produit exclusivement par des processus médiés par des radicaux libres, sont plus élevés chez les participants ayant des niveaux bas d’activité de la paraoxonase, suggère que PON1 peut influencer les événements oxydatifs d'influence au delà des voies de la cyclo-oxygénase et de la lipoxygénase.
Alors que le(s) mécanisme(s) des effets antioxydants systémiques médiés par PON1 reste à déterminer, les résultats actuels soutiennent fortement le rôle de cette protéine associée au HDL dans la modulation du stress oxydatif systémique chez l'homme. D'ailleurs, la présente étude suggère un lien mécaniste important entre PON1, le stress oxydatif systémique, et le risque de développement de maladie cardiaque athéroscléreuse et ses complications aiguës.
Dans une publication récente, il a été suggéré que la position 192 de l’acide aminé de PON1 participe à la liaison du HDL.28 Il a été montré que l’alloenzyme Q192 se lier à la particule de HDL avec une affinité inférieure de 3 fois à l’alloenzyme R192 et, par conséquent, montrait une stabilité inférieure, une activité de la lipolactonase, et un effet modulatoire sur le flux du cholestérol des macrophages. Les résultats de l'étude clinique actuelle complètent ces résultats, démontrant que les individus ayant une mutation de l’arginine (R) à la position 192 ont des niveaux sériques plus élevés de l'activité PON1, des index systémiques inférieurs du stress oxydatif systémique, et des réductions correspondantes de la prévalence de la maladie coronarienne et des événements cardiaques prospectifs.
Ceci est, à notre connaissance, la première grande étude prospective examinant de façon approfondie la génétique et l'activité biochimique de PON1 en utilisant des mesures duelles enzymatiques pour prévoir la prévalence de maladie, aussi bien que le risque éventuel de MACE, tout en simultanément examinant également si un mécanisme potentiel d’associations des MCV est lié aux mesures du stress oxydatif systémique chez l'homme. Comparé aux études antérieures qui se sont souvent concentrées sur des populations à faible risque, 15 la cohorte actuelle est également sensiblement enrichie par des patients ayant une maladie coronarienne et des artères périphériques, ce qui nous permet de mieux étudier l'association de la variante PON1 Q192R sur l'athérosclérose coronaire et extra-coronaire après ajustement sur des facteurs de risque établis.
Cependant, dans la présente étude, la diminution des niveaux d'activité systémique de l’arylestérase est demeurée significativement associée à l’incidence de MACE sur trois ans (critère composite comprenant les IDM, les AVC, ou les décès) dans le sous-groupe de participants sans antécédent ou preuve clinique de maladie coronarienne ou des artères périphériques et sans preuve angiographique significative de maladie coronarienne. En outre, la présente étude suggère également une valeur pronostique potentielle de la mesure de l'activité PON1 chez les patients. L'addition des mesures systémiques de l’activité PON1 aux facteurs de risque traditionnels et de la protéine C-réactive a apporté une amélioration par accroissement significative de la capacité à prévoir les résultats cliniques sur une période de trois ans.
Dans de larges études récentes d'association sur le génome, il n’a pu être observé de preuve d’association entre le gène PON1 et la maladie coronarienne ou les IDM.29,30 Une explication probable est que les grandes études d'association sur le génome ne sont pas idéales pour évaluer les gènes spécifiques candidats puisque le panel de SNP placé sur la séquence peut ne pas capturer toute les variations génétiques de tous les gènes particuliers.31 En outre, les larges études d'association sur le génome tendent à identifier des gènes ayant un effet génétique plus fort en raison de la rigueur lorsqu’on considère ce qui est statistiquement significatif. À cet égard, une faible association avec PON1 peut avoir été observée mais pas rapportée car n’ayant pas dépassé le seuil de signification basé sur des milliers de tests statistiques réalisés. Par ailleurs, un des phénotypes nous avons étudié, à savoir, la mortalité dans la cohorte, n’était pas le même que celui étudié dans les grandes études d'association sur le génome, ce qui pourrait également expliquer pourquoi une association avec PON1 n'a pas été rapportée.
Le gène PON1 est situé à proximité de 2 autres membres de la famille des gènes de la paraoxonase, PON2 et PON3, ce qui soulève la possibilité que l’association que nous avons observée pourrait être due à un déséquilibre de linkage avec une variante de PON2 ou de PON3. Cependant, un examen de la base de données HAPMAP dans la population blanche (qui est appariée à la cohorte GeneBank) prouve que la variante PON1 Q192R est située dans un bloc de haplotype dans lequel les SNP ont une déséquilibre modéré de linkage l’un avec l’autre. D'ailleurs, ce bloc de haplotype ne couvre que PON1 et ne se prolonge pas aux gènes PON2 et PON3. Ainsi, alors qu'il est possible que les variantes de PON2 et de PON3 puissent également contribuer à la modification de l’activité PON1 et au risque de MCV, les données disponibles de HAPMAP suggèrent que, chez les blancs, l’association observée avec la variante PON1 Q192R puisse ne pas être due à un déséquilibre de linkage avec d’autres variantes des gènes adjacents PON2 et PON3, mais résulte probablement de la modificatioin de la fonction PON1. Bien qu'il soit possible que d’autres variantes PON1 qui ont un déséquilibre de linkage avec le Q192R SNP soient les allèles causaux, des études récentes utilisant des mutants recombinants PON1 en position 192 ont prouvé que ce résidu est important pour la liaison avec HDL28 et suggèrent que le Q192R SNP soit la variante causale à la base des associations cliniques que nous observons. D'autres études abordant cette question sont requises.
Un certain nombre de précautions dans la présente étude doivent être prises. Tous les participants étaient destinés à avoir une angiographie coronaire diagnostique programmée, ce qui limite la généralisation des résultats actuels et soulève la possibilité d’une polarisation du choix. Cependant, les mesures de la paraoxonase et de l’activité de l’arylestérase chez les volontaires en bonne santé sont plus élevées que chez les participants ayant une MCV ou non évalués dans la présente étude. Étant donné que la majorité de participants étaient blancs, il reste également à déterminer si on observe les mêmes rapports au sein de grandes cohortes d'autres groupes raciaux/ethniques. Le pourcentage inférieur des participants non blancs dans notre cohorte (7.9%) a limité notre capacité à analyser le lien mécaniste entre PON1 et les index globaux de stress oxydatif systémique et de ce fait son association avec la MCV chez les participants d'autres origines raciales/ethniques. Il est également incertain de savoir si des problèmes médicaux concomitants ont influencé l’activité PON1 ; cependant, l'inclusion des facteurs de risque cardiaques traditionnels comprenant l'âge, le sexe, la race, le diabète, l'hypertension, le tabagisme, les lipides, la protéine C-réactive, et l'utilisation de médicament (les statines et l'aspirine) dans les analyses multivariées n'a pas changé les résultats.
Il est également possible que la réduction de l'activité PON1 puisse résulter de la présence de la maladie vasculaire plutôt que d’être la cause directe de futurs événements CVD. Cependant, les niveaux d'activité de l’arylestérase chez les participants ayant une preuve angiographique minimale de maladie coronarienne continuaient d’être liés indépendamment aux événements cardio-vasculaires incidents durant les trois ans suivant l’inclusion des participants, ce qui est compatible à une association de PON1 dans les processus athéroscléreux macrovasculaires précoces de la maladie. Indépendamment, l'observation courante d'une relation entre le polymorphisme de PON1 Q192R et l’activité PON1, le stress oxydatif, et les résultats MCV est compatible avec les résultats des modèles murins et fournit la preuve que la protéine PON1 protège contre le développement et la propagation de la MCV.
CONCLUSION
Les résultats actuels fournissent une preuve prospective directe d'un lien mécaniste important entre le gène PON1 et les mesures systémiques de l’activité PON1 pour les index quantitatifs multiples du stress oxydatif et le développement athéroscléreux cardiaque chez l'homme. La paraoxonase 1 est presque exclusivement trouvée en association aux particules de HDL dans la circulation et il est considéré qu’elle puisse favoriser certains des effets anti-inflammatoires et antioxydants attribués aux HDL. Les présentes études fournissent également donc davantage d'appui en faveur du concept que des propriétés fonctionnelles, allant au delà de la capacité du HDL et de ses protéines associées à favoriser le transport inverse du cholestérol, contribuent à la capacité globale de cette lipoprotéine à réduire ou prévenir le développement de l'atherosclérose.
Informations sur les auteurs
Correspondance: Stanley L. Hazen, MD, PhD, Center for Cardiovascular Diagnostics and Prevention, Cleveland Clinic, 9500 Euclid Ave, NE-10, Cleveland, OH 44195 (hazens{at}ccf.org).
Affiliations des auteurs: Department of Cell Biology (Drs Bhattacharyya, Nicholls, Zhang, M.-L. Brennan, et Hazen et Messrs Schmitt et Fu), Center for Cardiovascular Diagnostics and Prevention (Drs Bhattacharyya, Nicholls, Zhang, M.-L. Brennan, Hazen et Messrs Schmitt et Fu), Department of Cardiovascular Medicine (Drs Nicholls, Ellis, Hazen, Mr Shao, et Ms D.M. Brennan), Cleveland Clinic, Cleveland, Ohio; Scripps Research Institute and Scripps Clinic, La Jolla, Californie (Dr Topol); Departments of Medicine (Drs Yang et Lusis), Human Genetics (Dr Lusis), and Microbiology and Immunology (Dr Lusis), University of Californie, Department of Preventive Medicine, University of Southern California (Dr Allayee), Los Angeles.
Contributions des auteurs: Le Dr. Hazen a eu un plein accès à toutes les données de l’étude et accepte la responsabilité de l'intégrité des données et de l'exactitude de l'analyse des données. Hazen
Conception et schéma de l’étude: Lusis, Hazen.
Recueil des données: Bhattacharyya, Topol, Zhang, Yang, Schmitt, Fu, M.-L. Brennan, Allayee, Lusis, Hazen.
Analyse et interprétation des données: Bhattacharyya, Nicholls, Topol, Yang, Shao, D. M. Brennan, Ellis, Lusis, Hazen.
Rédaction du manuscrit: Bhattacharyya, Nicholls, Lusis, Hazen.
Revue critique du manuscrit: Bhattacharyya, Zhang, Schmitt, Fu, Shao, D. M. Brennan, M.-L. Brennan, Allayee, Lusis, Hazen.
Analyse statistique: Bhattacharyya, Nicholls, Yang, Shao, D. M. Brennan, Lusis, Hazen.
Obtention du financement: Topol, Allayee, Lusis, Hazen.
Aide administrative, technique ou matérielle: Bhattacharyya, Topol, Zhang, M.-L. Brennan, Allayee, Lusis, Hazen.
Supervision de l’étude: Nicholls, Topol, Ellis, M.-L. Brennan, Hazen.
Liens financiers: Dr. Nicholls rapporte qu'il a reçu des honoraires d’orateur de Pfizer, AstraZeneca, Merck, Schering-Charrue, et Takeda et de consultation de Roche, d'AstraZeneca, de Pfizer, et de Novo-Nordisk. Le Dr. Ellis rapporte qu'il est comme coinventeur des brevets en cours déposés par la clinique de Cleveland se référant à l'utilisation des marqueurs génétiques dans la maladie cardio-vasculaire. Dr. Ellis rapporte également qu'il a reçu un soutien pour ses recherches de Lilly, de Centocor, de Boston Scientific, et de Cardlodx et des honoraires de consultation de Celera, de CORDIS, de Boston Scientific, et d'Abbott vasculaire. Le Dr. Allayee rapporte qu'il est comme coinventeur des brevets en cours et approuvés déposés par l'Université de Californie liés à l'identification de la lipoxygénase 5 comme gène impliqué dans des traits liés au diabète et aux maladies cardiovasculaires. Le Dr. Allayee rapporte également qu'il a reçu des honoraires/honoraires de consultation de Reliant et Corautus Genetics. Le Dr. Lusis rapporte qu'il a reçu un soutien pour ses recherches de Merck, d'Anthera, et de Bristol-Myers Squibb. Le Dr. Hazen rapporte qu'il est coinventeur des brevets en cours et approuvés déposés par la clinique de Cleveland rapportant à l'utilisation des biomarqueurs des maladies inflammatoires et cardio-vasculaires. Le Dr. Hazen rapporte également qu'il est le fondateur scientifique de PrognostiX inc. ; a reçu un soutien pour ses recherches d’Abbott Diagnostics, de Pfizer, de Merck, de PrognostiX inc., de Hawaï Biotech, d'ArgiNOx, de Sanofi, et de Takeda ; il a reçu des honoraires et des honoraires de consultation d’Abbott Diagnostics, de BioSite, de Merck, Lilly, Pfizer, PrognostiX inc., Wyeth, de Biophysical, et d’AstraZeneca. Aucune autre declaration n'a été rapportée.
Financement/soutien: Cette étude a été soutenue par bourses des National Institutes of Health P01 HL076491, P01 HL077107, P01 HL087018, P01 HL30568, et RO1 HL079353, d’une récompense clinique et de d’un prix Clinical and Translational Science Award de la Cleveland Clinic (bourses 1KL2RR024990), et bourse 0435223N de l’AHA. Une partie de ce travail a été conduit dans un service construit avec l'appui de la bourse C06 (RR10600- 01, CA62528-01, RR14514-01) du programme d'amélioration des équipements de recherches du centre national pour les ressources de recherches.
Rôle des sponsors: Les organismes de financement n'ont joué aucun rôle dans la conception et la conduite de l'étude ; dans la collection, l'analyse, et l'interprétation des données ; ou dans la préparation, la revue, ou l'approbation du manuscrit.
BIBLIOGRAPHIE
 |  |
1. Mackness M, Mackness B. Paraoxonase 1 and atherosclerosis: is the gene or the protein more important? Free Radic Biol Med. 2004;37(9):1317-1323.
PUBMED
2. Li HL, Liu DP, Liang CC. Paraoxonase gene polymorphisms, oxidative stress, and diseases. J Mol Med. 2003;81(12):766-779.
PUBMED
3. Durrington PN, Mackness B, Mackness MI. Paraoxonase and atherosclerosis. Arterioscler Thromb Vasc Biol. 2001;21(4):473-480.
FREE FULL TEXT
4. Mackness MI, Arrol S, Durrington PN. Paraoxonase prevents accumulation of lipoperoxides in lowdensity lipoprotein. FEBS Lett. 1991;286(1-2):152-154.
PUBMED
5. Shih DM, Xia YR, Wang XP, et al. Combined serum paraoxonase knockout/apolipoprotein E knockout mice exhibit increased lipoprotein oxidation and atherosclerosis. J Biol Chem. 2000;275(23):17527-17535.
FREE FULL TEXT
6. Shih DM, Gu L, Xia YR, et al. Mice lacking serum paraoxonase are susceptible to organophosphate toxicity and atherosclerosis. Nature. 1998;394(6690):284-287.
PUBMED
7. Tward A, Xia YR, Wang XP, et al. Decreased atherosclerotic lesion formation in human serum paraoxonase transgenic mice. Circulation. 2002;106(4):484-490.
FREE FULL TEXT
8. Rozenberg O, Rosenblat M, Coleman R, et al. Paraoxonase (PON1) deficiency is associated with increased macrophage oxidative stress: studies in PON1-knockout mice. Free Radic Biol Med. 2003;34(6):774-784.
PUBMED
9. Reddy ST, Waldeigh DJ, Grijalva V, et al. Human paraoxonase-3 is an HDL-associated enzyme with biological activity similar to paraoxonase-1 protein but is not regulated by oxidized lipids. Arterioscler Thromb Vasc Biol. 2001;21(4):542-547.
FREE FULL TEXT
10. Hegele RA. Paraoxonase genes and disease. Ann Med. 1999;31(3):217-224.
PUBMED
11. Watzinger N, Schmidt H, Schumacher M, et al. Human paraoxonase 1 gene polymorphisms and the risk of coronary heart disease: a community-based study. Cardiology. 2002;98(3):116-122.
PUBMED
12. Robertson KS, Hawe E, Miller GJ, et al. Human paraoxonase gene cluster polymorphisms as predictors of coronary heart disease risk in the prospective Northwick Park Heart Study II. Biochim Biophys Acta. 2003;1639(3):203-212.
PUBMED
13. Lawlor DA, Day IN, Gaunt TR, et al. The association of the PON1 Q192R polymorphism with coronary heart disease: findings from the British Women’s Heart and Health cohort study and ameta-analysis. BMC Genet. 2004;5:17.
PUBMED
14. Brophy VH, Hastings MD, Clendenning JB, et al. Polymorphisms in the human paraoxonase (PON1) promoter. Pharmacogenetics. 2001;11(1):77-84.
PUBMED
15. Wheeler JG, Keavney BD, Watkins H, et al. Four paraoxonase gene polymorphisms in 11 212 cases of coronary heart disease and 12 786 controls: metaanalysis of 43 studies. Lancet. 2004;363(9410):689-695.
PUBMED
16. Mackness B, Davies GK, Turkie W, et al. Paraoxonase status in coronary heart disease: are activity and concentration more important than genotype? Arterioscler Thromb Vasc Biol. 2001;21(9):1451-1457.
FREE FULL TEXT
17. Zhang R, Brennan ML, Shen Z, et al. Myeloperoxidase functions as amajor enzymatic catalyst for initiation of lipid peroxidation at sites of inflammation. J Biol Chem. 2002;277(48):46116-46122.
FREE FULL TEXT
18. Newman TB, Brown AN. Use of commercial record linkage software and vital statistics to identify patient deaths. J Am Med Inform Assoc. 1997;4(3):233-237.
FREE FULL TEXT
19. Eckerson HW, Wyte CM, La Du BN. The human serum paraoxonase/arylesterase polymorphism. Am J Hum Genet. 1983;35(6):1126-1138.
PUBMED
20. Pencina MJ, D’Agostino RB. Overall C as a measure of discrimination in survival analysis: model specific population value and confidence interval estimation. Stat Med. 2004;23(13):2109-2123.
PUBMED
21. Kattan MW. Validating a prognostic model. Cancer. 2006;107(11):2523-2524.
PUBMED
22. Harrell FE, Califf RM, Pryor DB, et al. Evaluating the yield of medical tests JAMA. 1982;247(18):2543-2546.
FREE FULL TEXT
23. Kattan MW. Evaluating a new marker’s predictive contribution. Clin Cancer Res. 2004;10(3):822-824.
FREE FULL TEXT
24. Vivekananthan DP, Penn MS, Sapp SK, et al. Use of antioxidant vitamins for the prevention of cardiovascular disease: meta-analysis of randomised trials. Lancet. 2003;361(9374):2017-2023.
PUBMED
25. Lusis AJ, Fogelman AM, Fonarow GC. Genetic basis of atherosclerosis, I: new genes and pathways. Circulation. 2004;110(13):1868-1873.
FREE FULL TEXT
26. Thukkani AK, McHowat J, Hsu FF, et al. Identification of alpha-chloro fatty aldehydes and unsaturated lysophosphatidylcholine molecular species in human atherosclerotic lesions. Circulation. 2003;108(25):3128-3133.
FREE FULL TEXT
27. Shishehbor MH, Zhang R, Medina H, et al. Systemic elevations of free radical oxidation products of arachidonic acid are associated with angiographic evidence of coronary artery disease. Free Radic Biol Med. 2006;41(11):1678-1683.
PUBMED
28. Gaidukov L, Rosenblat M, Aviram M, et al. The 192R/Q polymorphs of serum paraoxonase PON1 differ in HDL binding, lipolactonase stimulation, and cholesterol efflux. J Lipid Res. 2006;47(11):2492-2502.
FREE FULL TEXT
29. Samani NJ, Erdmann J, Hall AS, et al. Genomewide association analysis of coronary artery disease. N Engl J Med. 2007;357(5):443-453.
PUBMED
30. Rosenzweig A.. Scanning the genome for coronary risk. N Engl J Med. 2007;357(5):497-499.
PUBMED
31. Shriner D, Vaughn LK, Padilla MA, Tiwari HK. Problems with genome-wide association studies. Science. 2007;316(5833):1840-1842.
PUBMED
ARTICLE EN RAPPORT
Cette semaine dans le JAMA-Français
JAMA. 2008;299:1225.
Texte Complet
|