 |
 |

Pages du praticien
Prise en charge de la rétinopathie diabétiqueUne revue systématique
Quresh Mohamed, MD;
Mark C. Gillies, MD, PhD;
Tien Y. Wong, MD, PhD
RÉSUMÉ
 |  |
Contexte: La rétinopathie diabétique (RD) est la
première cause de cécité dans la population active aux
États-Unis. De nombreuses interventions récentes sont
disponibles dans le traitement de cette pathologie, mais les données
soutenant leur utilisation sont inégales.
Objectif: Examiner les meilleures données relatives aux
interventions primaires et secondaires dans la prise en charge de la RD,
incluant l'œdème maculaire diabétique.
Acquisition des données: Revue systématique de tous
les articles de langue anglaise, obtenus en effectuant une recherche par
mots-clés sur MEDLINE (de 1966 à mai 2007), EMBASE, la base de
données Cochrane, celle de l'ARVO (Association for Research in Vision
and Ophthalmology), et la base de données d'études cliniques des
NIH (National Institutes of Health), suivie par des recherches manuelles dans
les listes de références des articles de revue majeurs
sélectionnés. Toutes les études contrôlées
randomisées (ECR) de langue anglaise avec plus de 12 mois de suivi,
ainsi que les méta-analyses ont été incluses. Des
critères de consensus Delphi ont été utilisés pour
identifier les études bien menées.
Synthèse des données: Quarante-quatre études
(dont 3 méta-analyses) répondaient aux critères
d'inclusion. Le contrôle strict de la glycémie et de la pression
artérielle réduit l'incidence et la progression de la RD. La
photocoagulation panrétinienne au laser réduit de 50 % le risque
de perte visuelle modérée et sévère chez les
patients avec rétinopathie sévère non proliférante
et proliférante. La photocoagulation au laser focale réduit le
risque de perte visuelle modérée de 50 % à 70 % chez les
patients atteints d'œdème maculaire. La vitrectomie
précoce améliore la récupération visuelle chez les
patients avec rétinopathie proliférante et hémorragie
vitréenne sévère. Les injections intra-vitréennes
de stéroïdes peuvent être envisagées en cas de perte
visuelle persistante, réfractaire au traitement conventionnel. Il
existe peu de données concernant la tolérance ou
l'efficacité du traitement hypolipémiant, des interventions
médicales, ou des inhibiteurs des facteurs de croissance
endothéliale vasculaire sur l'incidence ou la progression des RD.
Conclusions: Le contrôle strict de la glycémie et de la
pression artérielle reste la pierre angulaire dans la prévention
primaire de la RD. Les techniques de photocoagulation au laser
panrétinienne et focale réduisent le risque de perte visuelle
chez les patients ayant respectivement une RD sévère et un
œdème maculaire. Les données sont actuellement
insuffisantes pour recommander l'utilisation en routine des autres
traitements.
JAMA.
2007,298(8):902-916
Le diabète sucré affecte 200 millions de personnes à
travers le monde,1 dont 20 millions rien qu'aux
États-Unis.2
Dans ce pays, la rétinopathie diabétique (RD), qui est une
complication micro-vasculaire spécifique du diabète, est la
première cause de cécité dans la population
active.2 La
prévalence de la RD augmente avec la durée du
diabète;3
la quasi-totalité des personnes ayant un diabète de type 1 et
plus de 60% de celles avec un diabète de type 2 développent une
rétinopathie au bout de 20 ans. Les facteurs de risque majeurs de RD
ont été rapportés dans des études
épidémiologiques,3,4
et sont résumés dans l'Encadré.
La rétinopathie diabétique peut être classifiée
en 2 stades, non proliférante et proliférante. Les premiers
signes visibles de la RD non proliférante sont des
microanévrismes et des hémorragies rétiniennes
(Figure, A). La non-perfusion
capillaire progressive s'accompagne du développement de nodules
cotonneux, de veines moniliformes, et d'anomalies microvasculaires
intra-rétiniennes. La RD proliférante survient avec
l'ischémie rétinienne subséquente, et se
caractérise par la prolifération de néovaisseaux à
la surface de la rétine ou de la papille optique
(Figure, B). Ces vaisseaux
anormaux peuvent saigner, entraînant une hémorragie
vitréenne, une fibrose, et un décollement de rétine
tractionnel. L'œdème maculaire diabétique (OMD), qui peut
survenir à tous les stades de la RD, se caractérise par une
hyperperméabilité vasculaire et le dépôt d'exsudats
secs au centre de la rétine (Figure,
A). L'œdème maculaire est aujourd'hui la principale
cause de cécité chez les diabétiques.
|
|

|
|
Figure.. Rétinopathie diabétique non proliférante et
proliférante
A, Rétinopathie diabétique non proliférante
modérée avec microanévrismes, hémorragies
rétiniennes, et œdème maculaire caractérisé
par une hyperperméabilité vasculaire et la formation d'exsudats
durs au centre de la rétine. B, Rétinopathie diabétique
proliférante avec néovaisseaux et tissu fibreux tractionnel se
développant à partir de la papille.
|
|
|
Les interventions primaires, comme le contrôle de la glycémie
et de la pression artérielle, peuvent réduire l'incidence des
RD, tandis que les interventions secondaires, notamment la photocoagulation au
laser, peuvent empêcher leur progression et la perte de la vue. Il
existe de nombreuses interventions nouvelles, mais les données
soutenant leur utilisation sont inégales. Le présent article
fournit une revue systématique de la littérature visant à
déterminer les meilleures données relatives aux traitements
primaires et secondaires de la RD.
ACQUISITION DES DONNÉES
Sources de données
Nous avons effectué une recherche dans la littérature pour
identifier les études contrôlées randomisées (ECR)
de langue anglaise ou les méta-analyses évaluant les traitements
de la RD. Les articles ont été obtenus par une recherche sur
MEDLINE (de 1966 à mai 2007), EMBASE, la base de données
Cochrane, celle de l'ARVO (Association for Research in Vision and
Ophthalmology), ainsi que la base de données des études
cliniques des NIH (National Health Institutes) jusqu'en mai 2007. Les termes
de recherche incluaient les variations des mots-clés
rétinopathie, diabète, RD, OMD, néovascularisation
rétinienne, étude clinique contrôlée, et
étude contrôlée randomisée (ECR). Cette
procédure a été complétée par une recherche
manuelle dans les listes de références des articles de revue
majeurs. Dans la mesure où nous étions essentiellement
intéressés par des résultats à moyen terme, nous
avons exclu les articles comportant moins de 12 mois de suivi et ceux qui ne
séparaient pas les données des différents troubles
rétiniens (par exemple, œdème maculaire du
diabétique vs occlusion veineuse rétinienne). Nous avons
également exclu les complications secondaires des RD
proliférantes comme le glaucome et les décollements
tractionnels, qui dépassaient le cadre de cette revue.
Nous avons utilisé la liste des critères de consensus Delphi
pour sélectionner les études bien
menées.21
Les études étaient évaluées sur un formulaire
d'extraction des données standardisé pour (1) la validité
de la méthode de randomisation, (2) l'attribution aveugle du
traitement, (3) la similarité des groupes à l'inclusion
concernant les facteurs pronostiques majeurs, (4) les critères
d'éligibilité clairement spécifiés, (5) l'aveugle
des évaluateurs, (6) l'aveugle des fournisseurs de soins, (7) l'aveugle
des patients, (8) le rapport d'estimations en pourcentage et
d'évaluations de variabilité des critères, (9) l'analyse
en intention de traiter, et (10) le taux de perdus de vue acceptable, non
susceptible de produire un biais. Les études étaient
notées sur un maximum de 10, et celles ayant un score supérieur
à 5 étaient considérées comme étant de
qualité supérieure. Pour chaque intervention, nous avons
coté la qualité globale de la preuve en niveaux I, II ou III, et
la gradation des recommandations cliniques en niveaux A, B et C, en utilisant
des critères rapportés
précédemment.22
Critères d'évaluation
Pour les interventions primaires, les critères d'évaluation
incluaient l'incidence de nouvelle RD et le taux d'effets indésirables
de l'intervention. Pour les interventions secondaires, les critères
incluaient la progression de la RD, les changements dans l'acuité
visuelle et l'épaisseur maculaire, et les taux de cécité
légale et d'effets indésirables. L'accent était mis sur
les études dans lesquelles la meilleure acuité visuelle
corrigée était évaluée en aveugle en utilisant le
protocole ETDRS (Early Treatment Diabetic Retinopathy Study). Certaines ECR
évaluaient simultanément des interventions primaires (incidence
de RD) et secondaires (progression des RD). Les études utilisaient
différentes méthodes pour évaluer la rétinopathie,
notamment l'ophtalmoscopie clinique, la photographie rétinienne, et/ou
l'angiographie
fluorescéinique.23
Elles différaient également dans la classification des RD, la
plupart utilisant la classification de Airlie
House24
modifiée.25
Cette méthode d'évaluation de référence consiste
en la cotation de sept clichés stéréoscopiques à
30° de la rétine (7 champs standard), chaque cliché
étant comparé à des photographies standard. Un score,
s'échelonnant de 10 (pas de rétinopathie) à 85 (RD
proliférante évoluée), est ensuite attribué
à chaque œil, et les cotes des deux yeux sont combinées
dans une échelle graduelle. L'OMD était
généralement classifié comme absent ou présent.
Les définitions de la progression des RD étaient
également variables. L'étude DCCT (Diabetes Control and
Complications
Trial)26,27
définissait la progression par au moins 3 stades d'aggravation par
rapport à l'inclusion, tandis que l'étude UKPDS (United Kingdom
Prospective Diabetes
Study)28 la
définissait par une évolution de 2 stades par rapport à
l'inclusion. Les autres études utilisaient l'augmentation du nombre de
microanévrismes ou la nécessité d'une photocoagulation au
laser comme indicateurs de progression.
| Encadré. Résumé des facteurs de risque de
rétinopathie diabétique identifiés dans des études
épidémiologiques/de cohortes
Facteurs de risque régulièrement observés
Durée du
diabète3,5,6
Hyperglycémie/valeur
d'hémoglobine
glycosylée3,5-7
Hypertension3,8-10
Hyperlipidémie8,11-13
Grossesse14
Néphropathie/maladie
rénale15,16
Facteurs de risque moins régulièrement
observés
Obésité8
Tabagisme17
Consommation d'alcool
modérée18,19
Inactivité
physique20
|
|
SYNTHÈSE DES DONNÉES
Un total de 782 citations a été évalué, sur
lequel 44 études (dont 3 méta-analyses) d'interventions pour la
RD répondaient à nos critères d'inclusion.
Interventions primaires
Contrôle glycémique. De premières études
épidémiologiques ont montré une relation constante entre
les taux d'hémoglobine glycosylée (HbA1c) et l'incidence de
RD.5,7
Cette observation majeure a été confirmée dans de vastes
ECR démontrant que le contrôle strict de la glycémie
réduisait tant l'incidence que la progression de la RD
(Tableau 1). L'étude
DCCT,26,27,29,45 menée entre 1983 et 1993, randomisait 1 441 patients
avec un diabète de type 1 pour recevoir un traitement intensif ou
conventionnel de la glycémie. Sur un suivi de 6,5 ans, le traitement
intensif (HbA1C médiane, 7,2 %) réduisait l'incidence de RD de
7,6% (intervalle de confiance [IC] à 95%, 62%-85%) et la progression de
RD de 54 % (IC 95 %, 39 %-66 %) comparé au traitement conventionnel
(HbA1c médiane, 9,1
%).26,27,29,45
|
|

|
|
Tableau 1.. Études contrôlées randomisées évaluant le
rôle du contrôle glycémique dans la rétinopathie
diabétique
|
|
|
L'étude UKPDS31 rapportait des résultats similaires dans le
diabète de type 2. Cette étude randomisait 3 867 patients avec
un diabète de type nouvellement diagnostiqué pour recevoir un
traitement intensif ou conventionnel. Le traitement intensif réduisait
les événements microvasculaires de 25 % (IC 95 %, 7 %-40 %) et
le recours à la photocoagulation au laser de 29%. Les données de
cotation photographique rétinienne d'un sous-groupe de participants
montraient une association
similaire.17
Ces résultats ont été reproduits dans d'autres
études,33,46
dont une méta-analyse antérieure à l'étude DCCT34
(Tableau 1).
Les données observationnelles à long terme de l'étude
DCCT ont montré qu'en dépit d'une égalisation graduelle
des valeurs de HbA1C après la fin de l'étude, le taux de
progression des RD dans le groupe initialement traité de manière
intensive restait significativement inférieur au groupe de traitement
conventionnel,27,30
soulignant l'importance d'instituer un contrôle glycémique strict
précocement au cours du diabète. Ce concept est soutenu par les
résultats d'une autre
ECR,47 dans
laquelle les participants initialement assignés à un
contrôle glycémique intensif vs traitement conventionnel avaient
une incidence inférieure de rétinopathie sévère
à 10
ans.48
Le contrôle glycémique strict comporte deux effets
indésirables cliniquement majeurs. Le premier est un risque
d'aggravation précoce de la RD. Dans l'étude DCCT, cet effet a
été observé dans 13,1 % du groupe de traitement intensif
vs 7,6 % du groupe de traitement
conventionnel.49
Cependant, cet effet s'inversait à 18 mois, et aucun cas d'aggravation
précoce n'a entraîné de déficience visuelle grave.
Des taux d'événements indésirables similaires ont
été rapportés dans une
méta-analyse.35
Les participants à risque de développer cette aggravation
précoce avaient des taux supérieurs de HbA1c à
l'inclusion et présentaient une réduction plus rapide des taux
de HbA1c dans les 6 premiers mois, suggérant la nécessité
d'éviter les réductions rapides des taux de HbA1c dans la mesure
du possible. Deuxièmement, le contrôle glycémique strict
est un facteur de risque connu d'épisodes hypoglycémiques et
d'acidocétose
diabétique.34
Une méta-analyse de 14 ECR, incluant l'étude
DCCT,50
indiquait que le traitement intensif est associé à un risque
triplé d'hypoglycémie et un risque de 70 % supérieur
d'acidocétose comparé au traitement conventionnel. Le risque
d'acidocétose était 7 fois supérieur chez les patients
utilisant exclusivement des pompes à
insuline,50
suggérant que l'injection d'insuline pluriquotidienne pourrait
constituer une stratégie mieux tolérée.
Contrôle de la pression artérielle.
Dans les études épidémiologiques, il n'a pas
été démontré que la pression artérielle
était un facteur de risque constant d'incidence et de progression des
RD.8,9,51,52
Les données des ECR indiquent cependant que le contrôle strict de
la pression artérielle est un facteur modifiable majeur de l'incidence
et la progression des RD (Tableau
2). L'étude UKPDS28 randomisait 1 048 patients avec
hypertension pour recevoir un contrôle strict de la pression
artérielle (pression artérielle systolique/diastolique cible,
<150/ <85 mm Hg) ou un contrôle conventionnel (cible, <
180/< 105 mm Hg). Après 9 ans de suivi, les patients avec un
contrôle strict présentaient une réduction de 34 % (IC 99
%, 11 %-50 %) dans la progression de la RD, une réduction de 47 % (IC
99 %, 7 %-70 %) dans la dégradation de l'acuité visuelle, et de
35 % de la photocoagulation au laser comparé à ceux avec un
contrôle conventionnel.
|
|

|
|
Tableau 2.. Études contrôlées randomisées évaluant le
rôle du contrôle de la pression artérielle dans la
rétinopathie diabétique
|
|
|
Les résultats de l'étude UKPDS s'opposent à ceux de
l'étude ABCD (Appropriate Blood Pressure Control in
Diabetes),54-57
qui randomisait 470 patients avec diabète de type 2 et hypertension
pour recevoir un contrôle tensionnel intensif ou modéré.
Sur 5 ans, aucune différence intergroupe n'était observée
dans la progression de la RD. L'absence d'efficacité relevée
dans cette étude pourrait être liée au contrôle
glycémique plus faible, au suivi plus court, et aux niveaux de pression
artérielle inférieurs à l'inclusion comparés
à l'étude UKPDS. Il n'est pas clairement déterminé
s'il existe un seuil au-delà duquel une nouvelle réduction de la
pression artérielle n'a plus d'effet sur la progression de la RD.
Les effets du traitement par antihypertenseurs sont également
visibles chez les patients diabétiques normotendus. Dans un autre
groupe de l'étude ABCD,57 parmi 480 patients non hypertendus avec un
diabète de type 2, le contrôle intensif de la pression
artérielle réduisait significativement la progression de la RD
sur 5 ans comparé au contrôle modéré.
L'étude EUCLID (EURODIAB Controlled Trial of Lisinopril in
Insulin-Dependent Diabetes
Mellitus)56
évaluait les effets de l'inhibiteur de l'enzyme de conversion (IEC)
lisinopril sur la progression de la RD chez des patients normotendus,
normoalbuminuriques, avec diabète de type1. Sur 2 ans, le lisinopril
réduisait la progression de RD de 50 % (IC 95 %, 28 %-89 %) et
l'évolution vers la RD proliférante de 80
%.56
L'étude EUCLID était limitée par des différences
intergroupes dans les taux glycémiques initiaux (taux de HbA1c
inférieurs dans le groupe de traitement) et un suivi limité
à 2 ans. Cette étude, parallèlement à une autre
ECR plus
petite,58
suggérait que les IEC pourraient avoir un bénéfice
additionnel sur la progression de la RD, indépendamment de
l'abaissement de la pression artérielle. Cependant, les données
des études UKPDS53 et
ABCD54,57
n'ont pas démontré de supériorité des IEC sur les
autres traitements antihypertenseurs.
La question de savoir si les antihypertenseurs plus récents ont des
effets bénéfiques additionnels reste à résoudre.
Une récente petite ECR (n = 24) avec un suivi court (4 mois) a
rapporté une aggravation de l'OMD chez les patients traités par
l'antagoniste de l'angiotensine II (Sartan) losartan comparé aux
témoins.59
Deux vastes ECR sont actuellement en cours. L'étude ADVANCE (Action in
Diabetes and Vascular Disease) évaluera les effets de l'association
perindoprilindapamide sur l'incidence de
RD,60 et
l'étude DIRECT (Diabetic Retinopahty Candesartan Trial) évaluera
le sartan
candésartan.61
Traitement hypolipémiant. Les études observationnelles
suggèrent que la dyslipidémie augmente le risque de RD, et plus
particulièrement de
l'OMD.8,11
Une petite ECR menée chez 50 patients avec RD a trouvé une
tendance non significative en faveur d'une amélioration de
l'acuité visuelle chez les patients recevant un traitement par
simvastatine,62
tandis qu'une autre étude a rapporté une réduction des
exsudats durs, mais une absence d'amélioration dans l'acuité
visuelle chez les patients avec un OM clinique, traités par
clofibrate.63
Dans l'étude FIELD (Fenofibrate Intervention and Event Lowering in
Diabetes) (Tableau
3),64
sur 9 795 participants avec diabète de type 2, ceux traités par
fénofibrate étaient moins susceptibles que les témoins de
nécessiter un traitement au laser (5,2 % vs 3,6 %, p < 0,001).
Cependant, la sévérité de la RD, les indications du
traitement au laser, et le type de traitement laser (focal ou
panrétinien), n'étaient pas rapportés. L'étude
CARDS (Collaborative Atorvastatin Diabetes Study), une ECR de 2 830 patients
avec diabète de type 2, n'a pas démontré
d'efficacité de l'atorvastatine dans la réduction de la
progression des
RD.75,76
L'étude était limitée par des données manquantes
substantielles (seuls 65 % des patients avaient un statut de
rétinopathie documenté à l'inclusion) et l'absence de
cotation photographique des RD. Plusieurs ECR en cours, notamment
l'étude ASPEN (Atorvastatin Study for Prevention of Coronary Endpoints
in NIDDM),77
évalueront également les effets de l'atorvastatine sur la
RD.
|
|

|
|
Tableau 3.. Études contrôlées randomisées sur les
traitements médicaux de la rétinopathie diabétique
|
|
|
Interventions secondaires
Traitements médicaux. Antiagrégants plaquettaires.
L'étude ETDRS a démontré que l'aspirine (650 mg/j)
n'avait aucun effet bénéfique sur la progression de la RD ou la
perte d'acuité visuelle chez les patients avec OMD ou RD non
proliférante sévère, pendant 9 mois de suivi
(Tableau
3).65,66
Le traitement par aspirine n'était pas associé à un taux
majoré de
vitrectomie.65,66
Une ECR plus petite, évaluant l'aspirine seule et en association avec
le dipyridamole, rapportait une réduction des micro-anévrismes
à l'angiographie fluorescéinique dans les deux groupes
comparés au
placebo.67
Une tendance similaire était observée dans une petite ECR68
évaluant la ticlopidine, bien que ses résultats n'aient pas
été statistiquement significatifs.
Inhibiteurs de la protéine kinase C. L'hyperglycémie induit
la synthèse de diacylglycérol dans les cellules vasculaires,
entraînant l'activation des isoenzymes de la protéine kinase
C(PKC). L'activation excessive de PKC pourrait être impliquée
dans la physiopathologie de la RD. La ruboxistaurine, un inhibiteur de la PKC
actif oralement, a été évaluée dans l'étude
PKC-DRS (Protein Kinase C Diabetic Retinopathy Study)
(Tableau
3),69
qui randomisait 252 patients avec RD non proliférante
modérée à sévère pour recevoir de la
ruboxistaurine (8,16 ou 32 mg) ou un placebo. Aucune différence
significative n'était observée dans la progression de la RD
après 36 mois de suivi, bien que les patients traités par 32 mg
de ruboxistaurine aient présenté une réduction
significative du risque de déficience visuelle moyenne. Le traitement
était bien toléré, avec peu d'événements
indésirables, essentiellement constitués de symptômes
gastro-intestinaux légers. Une étude plus vaste, PKC-DRS2, qui
randomisait 685 patients, a démontré des résultats
similaires.70
L'étude PKC-DMES (Tableau
3) ne rapportait aucune réduction significative dans la
progression des RD ou l'incidence d'OMD chez 686 patients avec RD non
proliférante minime à modérée et sans traitement
au laser
antérieur.71,78
Une tendance était observée en faveur d'une réduction de
l'OMD clinique chez les patients traités par 32 mg de ruboxistaurine (p
=0,04), avec un effet plus marqué lors de l'exclusion des patients
ayant des taux de HbA1c de 10 % ou plus (p = 0,02).
Inhibiteurs de l'aldose réductase. L'aldose réductase, enzyme
limitante de la voie des polyols dans le métabolisme du glucose, est
impliquée dans la pathogenèse de la RD. Deux inhibiteurs de
l'aldose réductase, le sorbinil (Pfizer, New York, New York) et le
tolrestat (Wyeth-Ayerst, St Davids, Pennsylvanie), n'ont
démontré aucun effet statistiquement significatif dans la
réduction de l'incidence ou de la progression des RD dans des ECR de 3
à 5
ans.72
Inhibiteurs de l'hormone de croissance/facteur de croissance analogue
à l'insuline. Des observations relatives à l'amélioration
des RD après hypophysectomie
chirurgicale79,80
et à l'augmentation des taux sériques et oculaires du facteur de
croissance analogue à l'insuline (IGF) chez des patients avec RD
sévère, ont justifié des études évaluant
l'utilisation d'inhibiteurs de la voie IGF/hormone de croissance dans la
prévention des
RD.81 Une
petite ECR, menée sur 15 mois chez 23 patients, a rapporté une
réduction de la sévérité de la rétinopathie
sous octréotide, un analogue de synthèse de la somatostatine qui
bloque l'hormone de
croissance,74
mais une autre ECR réalisée sur 1 an chez 20
patients,82
évaluant l'injection sous-cutanée continue d'octréotide,
n'a démontré aucun bénéfice significatif. Deux ECR
plus vastes en cours, évaluant l'injection d'octréotide à
libération
prolongée,83,84
ont rapporté des résultats préliminaires peu
concluants,85
avec des effets indésirables significatifs (diarrhées, calculs
biliaires, épisodes hypoglycémiques). Traitements laser et
chirurgical des RD proliférantes et non proliférantes
sévères. Photocoagulation panrétinienne au laser. La
photocoagulation panrétinienne au laser (PPR), qui consiste à
appliquer des brûlures laser sur l'ensemble de la rétine en
épargnant la macula centrale, est une technique reconnue dans le
traitement des RD proliférantes et non proliférantes
sévères86 (Tableau
4).
|
|

|
|
Tableau 4.. Études contrôlées randomisées sur le traitement
au laser des rétinopathies diabétiques non proliférantes
et proliférantes et de l'œdème maculaire
diabétique
|
|
|
Les données les plus concluantes sont issues de 2 ECR
associées, menées dans les années 1970 et 1980, les
études DRS (Diabetic Retinopathy
Study)86,88
et
ETDRS.102
L'étude DRS randomisait 1 758 patients avec RD proliférante dans
au moins 1œil ou RD non proliférante sévère
bilatérale, pour recevoir une PPR ou aucun traitement. À 2 ans,
une perte visuelle sévère (acuité visuelle <5/200
à 2 visites successives) était observée dans 6,4 % des
yeux traités vs 15,9 % des yeux non traités, le
bénéfice le plus important étant obtenu dans les yeux
présentant des caractéristiques de haut risque
(néovaisseaux papillaires ou hémorragie du vitré avec
néovaisseaux par ailleurs [Figure,
B]), dans lesquels le risque de déficience visuelle
sévère était réduit de 50
%.86
L'étude ETDRS102 randomisait 3711 patients avec une RD moins
sévère et une acuité visuelle supérieure à
20/100 pour recevoir une PPR précoce ou différée (4 mois
d'observation et traitement en cas de développement d'une RD
proliférante à haut risque). Le traitement précoce par
PPR réduisait le risque de RD proliférante à haut risque
de 50% comparé au traitement différé, bien que
l'incidence de perte visuelle sévère ait été
faible dans les deux groupes (2,6 % vs 3,7 %). D'autres ECR91-93 et une
méta-analyse incluant les données combinées de 2 243
patients87 ont confirmé l'efficacité de la PPR.
Les effets indésirables de la PPR incluent la diminution du champ
visuel (avec répercussions sur la
conduite103,104),
la cécité nocturne, l'altération de la perception des
couleurs, les brûlures laser involontaires, l'œdème
maculaire, le glaucome aigu, et le décollement de rétine par
traction.105
Une perte visuelle peut également survenir immédiatement
après la PPR. L'étude DRS a rapporté une perte de vision
de 2 à 4 lignes dans les 6 semaines suivant la PPR chez 10 % à
23 % des patients vs 6 % des
témoins.106
Vitrectomie chirurgicale pour l'hémorragie vitréenne et la RD
proliférante. La vitrectomie est utilisée dans le traitement des
yeux avec une RD évoluée, incluant la RD proliférante
avec hémorragie vitréenne non résolutive ou fibrose, des
zones de traction impliquant ou menaçant la macula, et plus
récemment, de l'OMD persistant avec traction vitréenne
(Tableau
5).115
L'étude DRVS (Diabetic Retinopathy Vitrectomy Study) randomisait 616
yeux avec hémorragie vitréenne récente et acuité
visuelle de 5/200 ou moins pendant au moins 1 mois, pour être soumis
à une vitrectomie précoce dans les 6 mois ou à une
observation.107,108,116,117
Après un suivi de 2 ans, 25 % des patients du groupe de vitrectomie
précoce vs 15 % du groupe d'observation avaient une vision de 20/40 ou
plus, avec des bénéfices persistant à 4 ans et plus chez
les individus avec un diabète de type 1. La chirurgie
vitréo-rétinienne a considérablement progressé
depuis l'étude DRVS. Ces avancées incluent l'imagerie du fond
d'œil peropératoire, ainsi que le traitement au laser et et
l'instrumentation bi manuelle pour la manipulation de la rétine. Elles
ont élargi les indications de la vitrectomie et pourraient
améliorer les
pronostics.118
|
|

|
|
Tableau 5.. Études contrôlées randomisées sur les
traitements chirurgicaux de la rétinopathie diabétique
proliférante et de l'œdème maculaire diabétique
|
|
|
Traitements laser et chirurgical de l'œdème maculaire
diabétique. Traitement localisé au laser. Comme pour la PPR, il
existe des données fiables démontrant que le traitement
localisé au laser préserve la vision en cas d'OMD.
L'étude ETDRS96 randomisait 1 490 yeux avec OMD pour être soumis
à un traitement au laser focal ou à une observation. À 3
ans, le traitement réduisait significativement la déficience
visuelle moyenne comparé à l'observation,96 les
bénéfices les plus importants étant observés chez
les patients avec OM
clinique.119
Il existe peu de données démontrant un impact du type de laser
(argon, diode, colorant, krypton) ou de la méthode utilisés sur
les
résultats.97,120-122
Les effets indésirables de ce traitement incluent les brûlures
involontaires de la fovéa, l'altération du champ visuel central,
de la vision des couleurs, la fibrose rétinienne, et l'extension des
cicatrices de
laser.105,106
Vitrectomie chirurgicale dans l'œdème maculaire
diabétique. L'OMD diffus, réfractaire au traitement
localisé au laser peut bénéficier de la
vitrectomie.123-126
Cependant, les rares ECR réalisées à ce jour avaient des
échantillons de petite taille et des suivis courts, avec des
résultats irréguliers
(Tableau 5). Une ECR de 28
patients avec OMD diffus a rapporté une réduction de
l'épaisseur maculaire et une amélioration de l'acuité
visuelle à 6 mois, après une vitrectomie vs
observation.127
La vitrectomie était supérieure au traitement localisé au
laser dans une
ECR,128
mais pas dans les
autres.112,113
Les complications de la vitrectomie incluent l'hémorragie
vitréenne récidivante, les déchirements et le
décollement de la rétine, la formation de cataracte, et le
glaucome. La présence de traction vitréenne et
d'œdème maculaire –désormais facilement
documentés avec la tomographie en cohérence
optique-associée à la déficience visuelle sont
actuellement une indication courante de la vitrectomie.
Corticoïdes intravitréens. Les corticoïdes ont des effets
anti-inflammatoires et anti-angiogéniques puissants. La triamcinolone
en injection intravitréenne (IVT), c'est-à-dire l'injection
d'acétonide de triamcinolone dans le corps
vitré,129
est utilisée dans le traitement de
l'OMD,130-132
un certain nombre d'ECR démontrant des améliorations
significatives de l'OMD et de l'acuité
visuelle.133-138
Beaucoup avaient cependant un nombre restreint de participants et une
durée de suivi courte. En outre, des effets indésirables
substantiels étaient observés, incluant des infections, des
glaucomes et la formation de
cataracte.109,139-142
Dans la plus vaste ECR avec le plus long suivi rapportée à ce
jour, les patients avec OMD persistant étaient randomisés pour
recevoir 4 mg d'IVT ou une injection placebo (injection sous-conjonctivale de
sérum
physiologique).109
Après 2 ans, 19 sur 34 yeux traités par IVT (56%)
présentaient une amélioration de l'acuité visuelle de 5
lettres ou plus, comparé à 9 sur 35 yeux traités par
placebo (26 %) (p = 0,007). Globalement, les yeux traités par IVT
avaient deux fois plus de chance de présenter une amélioration
de l'acuité visuelle et deux fois moins de risque de progression de la
déficience. Cependant, des injections répétées
étaient nécessaires dans de nombreux cas (moyenne, 2,2), et une
élévation significative de la pression intraoculaire
était observée (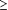 5 mm Hg dans 68% des yeux traités vs
10 % des témoins). La chirurgie de la cataracte était
nécessaire pour 55 % des yeux traités par IVT. Ainsi, bien que
cette étude ait démontré une efficacité
significative de l'IVT dans l'OMD persistant, des ECR plus vastes sont
nécessaires pour mieux documenter les bénéfices et la
tolérance à long terme du
traitement.143
En outre, la dose optimale de triamcinolone reste
indéterminée.144 5 mm Hg dans 68% des yeux traités vs
10 % des témoins). La chirurgie de la cataracte était
nécessaire pour 55 % des yeux traités par IVT. Ainsi, bien que
cette étude ait démontré une efficacité
significative de l'IVT dans l'OMD persistant, des ECR plus vastes sont
nécessaires pour mieux documenter les bénéfices et la
tolérance à long terme du
traitement.143
En outre, la dose optimale de triamcinolone reste
indéterminée.144
Plus récemment, des implants intravitréens ou
rétiniens ont été développés, permettant
une libération prolongée de la substance. De l'acétonide
de fluocinolone intravitréen implanté chirurgicalement
(Retisert; Bausch & Lomb, Rochester, New York) a été
évalué chez 97 patients avec OMD, randomisés pour
recevoir un implant ou des soins standard (traitement au laser ou
observation).110
À 3 ans, 58 % des patients ayant reçu un implant vs 30 % des
témoins présentaient une résolution de l'OMD (p <
0,001) associée à une amélioration de l'acuité
visuelle. Cependant, les effets indésirables incluaient un risque de
formation de cataracte et de glaucome substantiellement supérieur
à celui observé chez les patients recevant l'IVT, 5 %
nécessitant le retrait de l'implant pour traiter le
glaucome.110
Un implant injectable intravitréen de dexaméthasone à
libération prolongée, biodégradable (Posurdex; Allergan,
Irvine, Californie), a été évalué dans une ECR,
avec des améliorations rapportées dans l'acuité visuelle
et l'épaisseur
maculaire.145
Cependant, cette étude incluait également des patients avec
œdème maculaire dus à d'autres causes (occlusion veineuse
rétinienne, uvéite, et chirurgie de la cataracte
ultérieure) et avait un suivi relativement court. Une ECR plus vaste
sur le Posurdex dans le traitement de l'OMD est actuellement en cours.
Anti-angiogéniques intravitréens. Plusieurs ECR en cours
évaluent 3 inhibiteurs du facteur de croissance endothéliale
vasculaire (VEGF) dans le traitement de l'OMD. Le pegaptanib (Macugen; Pfizer,
New York, New York) cible l'isoforme VEGF-165 dans le traitement de la
dégénérescence maculaire liée à l'âge
(DMLA) néovasculaire. Une ECR de 172 patients avec OMD,
randomisés pour recevoir des injections intra-vitréennes
répétées de pegaptanib ou des injections placebo, a
démontré que les yeux traités étaient plus
susceptibles de présenter une amélioration de l'acuité
visuelle de 10 lettres ou plus (34 % vs 10 %, p = 0,03), de l'épaisseur
maculaire (p = 0,02), et de la nécessité d'un traitement au
laser focal (p = 0,04), à 36
semaines.146
Des infections graves sont survenues dans 1 des 652 injections (0,15 %), mais
n'étaient pas associées à une perte visuelle
sévère.146
L'analyse des données rétrospectives de 16 yeux avec RD
proliférante a également démontré une
régression de la
néovascularisation.147
Le ranibizumab (Lucentis; Genen-tech, South San Francisco, Californie),
autre anti-VEGF utilisé dans le traitement de la DMLA
néovasculaire,148,149
peut également être utile dans le traitement de la RD et de
l'OMD.150
Une ECR de phase2 (étude RESOLVE) évalue actuellement le
ranibizumab dans l'OMD. Enfin, le bevacizumab (Avastine, Genentech) est un
anti-VEGF similaire au ranibizumab, qui est approuvé dans le traitement
du cancer colorectal généralisé, mais non indiqué
en usage intraoculaire. Il semble cependant présenter une
efficacité similaire dans le traitement de la DMLA
néovasculaire, et pourrait également être efficace dans
l'OMD et la RD
proliférante.151-154
Le bevacizumab suscite l'intérêt en raison de son faible
coût, mais sa tolérance systémique est
préoccupante.155
Une ECR en cours, organisée par le US National Eye Institute, compare
les effets du traitement au laser, du bevacizumab intravitréen, et de
l'association bevacizumab intravitréen et laser ou injection placebo,
sur
l'OMD.156
COMMENTAIRE
Interventions primaires
Il existe des données concluantes soutenant que le contrôle
glycémique strict réduit l'incidence et la progression des RD
(Tableau 6). Pour le
diabète de type 1, l'étude DCCT a démontré que
chaque diminution de 10 % du taux de HbA1c (9 % à 8 % par exemple)
réduit le risque de RD de 39 %; cet effet bénéfique
persiste longtemps après la période de contrôle intensif.
Dans le diabète de type 2, l'étude UKPD a démontré
que chaque diminution de 10 % du taux de HbA1c réduit de 25 % (IC 95 %,
7 %-40 %) le risque d'événements microvasculaires, dont la
RD.
|
|

|
|
Tableau 6.. Résumé des recommandations cliniques relatives aux
interventions primaires et secondaires dans la rétinopathie
diabétique
|
|
|
Il existe également des données fiables soutenant que le
contrôle strict de la pression artérielle chez les patients
diabétiques avec hypertension est bénéfique dans la
réduction de la déficience visuelle due à la RD.
L'étude UKPDS a démontré que chaque diminution de 10 mm
Hg de la pression artérielle systolique réduit de 13 % le risque
de complications microvasculaires, indépendamment du contrôle
glycémique. Le bénéfice du traitement de la pression
artérielle chez les patients diabétiques normotendus est moins
clair.
Les données sur les bénéfices du traitement
hypolipémiant dans la prévention des RD restent peu concluantes.
Le fait que l'aspirine, d'autres antiagrégants plaquettaires, ou les
inhibiteurs de l'aldose réductase confèrent un quelconque
bénéfice dans la réduction de la progression des RD est
également peu documenté. Le rôle de la PKC et des
inhibiteurs de l'hormone de croissance est actuellement
indéterminé, et les résultats des études actuelles
sont en attente.
Interventions secondaires
RD proliférante. Il existe des données concluantes soutenant
que la PPR réduit significativement le risque de déficience
visuelle sévère due à la RD proliférante, d'au
moins 50 %. Les bénéfices les plus marqués sont
observés chez les patients avec RD proliférante à haut
risque, chez lesquels la PPR doit être initiée sans
délai.89
La vitrectomie précoce doit être envisagée chez les
patients avec diabète de type 1 et hémorragie vitréenne
persistante ou lorsque l'hémorragie empêche un autre traitement.
Les bénéfices de la vitrectomie sont moins clairs chez les
patients ayant un diabète de type 2. Avec les avancées
réalisées dans la chirurgie vitréo-rétinienne, la
vitrectomie pourrait être indiquée plus précocement dans
le traitement des yeux avec hémorragie non résolutive.
RD non proliférante. Bien qu'il existe des preuves de niveau I que
la PPR précoce réduit le risque de déficience visuelle
sévère dans les RD non proliférantes, la réduction
absolue du risque liée au traitement par PPR précoce est faible,
et les risques du traitement différé sont mineurs. Dans les RD
non proliférantes minimes à modérées, les facteurs
systémiques, tels que le contrôle de la glycémie et de la
pression artérielle, doivent être optimisés graduellement,
et la PPR différée avec un suivi rapproché.
L'étude ETDRS et d'autres ECR95 suggèrent que la PPR doit
être envisagée dans les RD non proliférantes plus
sévères, plus particulièrement chez les patients avec un
diabète de type 2. Le bénéfice de la PPR doit être
envisagé en tenant compte du faible risque de perte visuelle. La PPR
précoce est recommandée chez ces patients si un examen de suivi
régulier n'est pas réalisable, en cas d'opacité
significative ou de cataracte susceptibles d'affecter la capacité
ultérieure à appliquer un traitement au laser, ou en
présence de facteurs de risque concomitants (grossesse par exemple) de
progression rapide.
 dème maculaire diabétique. Il existe des
données concluantes soutenant que la photocoagulation au laser focale
réduit d'au moins 50 % le risque de déficience visuelle moyenne
dans l'OMD qui pose un risque de fixation (ou OM clinique), tout en augmentant
les chances d'amélioration visuelle. Chez les patients avec RD
proliférante et OMD associé, le traitement au laser focal
concomitant ou précédant la PPR est
recommandé.89 dème maculaire diabétique. Il existe des
données concluantes soutenant que la photocoagulation au laser focale
réduit d'au moins 50 % le risque de déficience visuelle moyenne
dans l'OMD qui pose un risque de fixation (ou OM clinique), tout en augmentant
les chances d'amélioration visuelle. Chez les patients avec RD
proliférante et OMD associé, le traitement au laser focal
concomitant ou précédant la PPR est
recommandé.89
Il existe des données de qualité moyenne relatives à
l'utilité potentielle de l'IVT dans le traitement de l'OMD et de la
perte visuelle persistant malgré un traitement conventionnel, incluant
le traitement au laser focal et le contrôle des facteurs de risque
systémiques. Les patients doivent être informés des effets
indésirables potentiels et de la nécessité de pratiquer
des réinjections. De nouvelles études sont nécessaires
pour déterminer la dose optimale, ainsi que l'efficacité et la
tolérance à moyen terme de ce traitement. Les anti-VEGF
intravitréens sont en cours d'évaluation dans plusieurs
études cliniques; jusqu'à ce que leurs résultats soient
disponibles, les données sont insuffisantes à ce jour pour
recommander leur utilisation en routine.
Il existe de faibles niveaux de preuve relatifs au bénéfice
potentiel de la vitrectomie chez certains patients avec OMD,
particulièrement en présence d'une traction
vitréo-maculaire associée; des études bien menées
avec un suivi plus long sont nécessaires.
CONCLUSIONS
Bien que la RD reste la première cause de cécité
évitable chez les adultes actifs, il existe des interventions primaires
et secondaires à l'efficacité démontrée,
permettant de limiter la déficience visuelle. Les indications,
l'efficacité et la tolérance des traitements médicaux et
chirurgicaux plus récents nécessitent cependant des
évaluations complémentaires.
Informations sur les auteurs
Correspondance: Tien Y. Wong, MD, PhD, Centre for Eye Research
Australia, University of Melbourne, 32 Gisborne St E, Melbourne Victoria,
Australia 3002
(twong{at}unimelb.edu.au).
Rédacteur en chef de la section Revue Clinique: Michael S.
Lauer, MD.
Nous encourageons les auteurs à soumettre leurs articles en vue de
publication dans la section Revue Clinique. Prière de contacter contact
Michael S. Lauer, MD, à
michael.lauer{at}jama-archives.org.
Contributions des auteurs: Le Dr Wong a eu un accès complet
à toutes les données de l'étude et accepte la
responsabilité de l'intégrité des données et de
l'exactitude de l'analyse des données.
Concept et schéma de l'étude: Mohamed, Gillies, Wong.
Recueil des données: Mohamed, Gillies.
Analyse et interpretation des données: Mohamed, Wong.
Rédaction du manuscrit: Mohamed, Gillies, Wong.
Revue critique du manuscrit: Gillies, Wong.
Analyse statistique: Mohamed, Wong.
Obtention du financement: Gillies.
Aide administrative, technique et matérielle: Mohamed, Gillies,
Wong.
Supervision de l'étude: Gillies, Wong.
Liens financiers: Le Dr Gillies déclare qu'il est reconnu
comme inventeur de licences pour la formule du triamcinolone dans son
utilisation oculaire et son utilisation dans les néo-vascularisations
rétiniennes, mais pas dans l'œdème diabétique
maculaire. Les Dr Gillies et Wong déclarent avoir siégé
aux conseils consultatifs et comme investigateurs dans des essais cliniques
sur la rétinopathie diabétique sponsorisés par Pfizer,
Novartis, et Allergan et avoir reçu des bourses, honoraires et
remboursement de frais de voyages de la part de ces sociétés.
Aucun autre lien n'a été rapporté.
Financement/Soutien: Cette étude a été
financée par le National Health and Medical Research Council of
Australia grant 352312.
Rôle du sponsor: Le National Health and Medical Research
Council of Australia n'a joué aucun rôle dans le schéma et
la conduite de l'étude, le recueil, l `analyse et
l'interprétation des données, la preparation, la revue et
l'approbation du manuscrit.
Affiliations des auteurs: Centre for Eye Research Australia,
University of Melbourne and Royal Victorian Eye and Ear Hospital, Melbourne,
Australia (Drs Mohamed et Wong); Cheltenham General Hospital, Cheltenham,
England (Dr Mohamed); Save Sight Institute, University of Sydney, Australia
(Dr Gillies); Singapore Eye Research Institute, Yong Loo Lin School of
Medicine, National University of Singapore (Dr Wong).
BIBLIOGRAPHIE
 |  |
1. International Diabetes Federation. Diabetes atlas 2005.
http://www.eatlas.idf.org.
Accessed May 2006.
2. US Centers for Disease Control and Prevention. National
Diabetes Fact Sheet: General Information and National Estimates on Diabetes in
the United States, 2005. Atlanta, GA: Centers for Disease Control
and Prevention; 2005.3. Klein R, Klein BE, Moss SE, Cruickshanks KJ. The Wisconsin
Epidemiologic Study of Diabetic Retinopathy, XVII: the 14-year incidence and
progression of diabetic retinopathy and associated risk factors in type 1
diabetes. Ophthalmology.1998; 105(10):1801
-1815.
PUBMED
4. Wong TY, Klein R, Islam FM, et al. Diabetic retinopathy in a
multi-ethnic cohort in the United States. Am J
Ophthalmol.2006; 141(3):446
-455.
PUBMED
5. Olsen BS, SjØlie A, Hougaard P, et al; Danish Study Group of
Diabetes in Childhood. A 6-year nationwide cohort study of glycaemic control
in young people with type 1 diabetes: risk markers for the development of
retinopathy, nephropathy and neuropathy. J Diabetes
Complications.2000; 14(6):295
-300.
PUBMED
6. van Leiden HA, Dekker JM, Moll AC, et al. Risk factors for incident
retinopathy in a diabetic and non-diabetic population: the Hoorn study.
Arch Ophthalmol.2003; 121(2):245
-251.
FREE FULL TEXT
7. Klein R, Palta M, Allen C, Shen G, Han DP, D'Alessio DJ. Incidence
of retinopathy and associated risk factors from time of diagnosis of
insulin-dependent diabetes. Arch Ophthalmol.1997; 115(3):351
-356.
FREE FULL TEXT
8. van Leiden HA, Dekker JM, Moll AC, et al. Blood pressure, lipids,
and obesity are associated with retinopathy: the hoorn study.
Diabetes Care.2002; 25(8):1320
-1325.
FREE FULL TEXT
9. Klein R, Moss SE, Klein BE, Davis MD, DeMets DL. The Wisconsin
epidemiologic study of diabetic retinopathy, XI: the incidence of macular
edema. Ophthalmology.1989; 96(10):1501
-1510.
PUBMED
10. Klein BE, Klein R, Moss SE, Palta M. A cohort study of the
relationship of diabetic retinopathy to blood pressure. Arch
Ophthalmol.1995; 113(5):601
-606.
FREE FULL TEXT
11. Klein R, Sharrett AR, Klein BE, et al; ARIC Group. The association
of atherosclerosis, vascular risk factors, and retinopathy in adults with
diabetes: the atherosclerosis risk in communities study.
Ophthalmology.2002; 109(7):1225
-1234.
PUBMED
12. Klein R, Klein BE, Moss SE, Linton KL. The Beaver Dam Eye Study:
retinopathy in adults with newly discovered and previously diagnosed diabetes
mellitus. Ophthalmology.1992; 99(1):58
-62.
PUBMED
13. Chew EY, Klein ML, Ferris FL, et al. Association of elevated serum
lipid levels with retinal hard exudate in diabetic retinopathy: Early
Treatment Diabetic Retinopathy Study (ETDRS) Report 22. Arch
Ophthalmol.1996; 114(9):1079
-1084.
FREE FULL TEXT
14. Klein BE, Moss SE, Klein R. Effect of pregnancy on progression of
diabetic retinopathy. Diabetes Care.1990; 13(1):34
-40.
PUBMED
15. Cruickshanks KJ, Ritter LL, Klein R, Moss SE. The association of
microalbuminuria with diabetic retinopathy: the Wisconsin Epidemiologic Study
of Diabetic Retinopathy. Ophthalmology.1993; 100(6):862
-867.
PUBMED
16. Klein R, Moss SE, Klein BE. Is gross proteinuria a risk factor for
the incidence of proliferative diabetic retinopathy?
Ophthalmology.1993; 100(8):1140
-1146.
PUBMED
17. Stratton IM, Kohner EM, Aldington SJ, et al. UK-PDS 50: risk
factors for incidence and progression of retinopathy in type II diabetes over
6 years from diagnosis. Diabetologia.2001; 44(2):156
-163.
PUBMED
18. Moss SE, Klein R, Klein BE. Association of cigarette smoking with
diabetic retinopathy. Diabetes Care.1991; 14(2):119
-126.
PUBMED
19. McKay R, McCarty CA, Taylor HR. Diabetic retinopathy in Victoria,
Australia: the Visual Impairment Project. Br J
Ophthalmol.2000; 84(8):865
-870.
FREE FULL TEXT
20. Kriska AM, LaPorte RE, Patrick SL, Kuller LH, Orchard TJ. The
association of physical activity and diabetic complications in individuals
with insulindependent diabetes mellitus: the Epidemiology of Diabetes
Complications Study–VII. J Clin Epidemiol.1991; 44(11):1207
-1214.
PUBMED
21. Verhagen AP, de Vet HC, de Bie RA, et al. The Delphi list: a
criteria list for quality assessment of randomized clinical trials for
conducting systematic reviews developed by Delphi consensus. J Clin
Epidemiol.1998; 51(12):1235
-1241.
PUBMED
22. Minckler D. Evidence-based ophthalmology series and content based
continuing medical education for the journal.
Ophthalmology.2000; 107:9
-10.
23. Early Treatment Diabetic Retinopathy Study Research Group.
Classification of diabetic retinopathy from fluorescein angiograms: ETDRS
report number 11. Ophthalmology.1991; 98(5)(suppl):807
-822.
PUBMED
24. Early Treatment Diabetic Retinopathy Study Research Group. Grading
diabetic retinopathy from stereoscopic color fundus photographs–an
extension of the modified Airlie House classification: ET-DRS report number
10. Ophthalmology.1991; 98 (5)(suppl):786
-806.
PUBMED
25. Aldington SJ, Kohner EM, Meuer S, Klein R, SjØlie AK.
Methodology for retinal photography and assessment of diabetic retinopathy:
the EURODIAB IDDM complications study. Diabetologia.1995; 38(4):437
-444.
PUBMED
26. Diabetes Control and Complications Trial Research Group.
Progression of retinopathy with intensive versus conventional treatment in the
Diabetes Control and Complications Trial.
Ophthalmology.1995; 102(4):647
-661.
PUBMED
27. Diabetes Control and Complications Trial/Epidemiology of Diabetes
Interventions and Complications Research Group. Retinopathy and nephropathy in
patients with type 1 diabetes four years after a trial of intensive therapy.
N Engl J Med.2000; 342 (6):381
-389.
PUBMED
28. UK Prospective Diabetes Study Group. Tight blood pressure control
and risk of macrovascular and microvascular complications in type 2 diabetes:
UKPDS 38. BMJ.1998; 317(7160):703
-713.
FREE FULL TEXT
29. The relationship of glycemic exposure (HbA1c) to the risk of
development and progression of retinopathy in the diabetes control and
complications trial. Diabetes.1995; 44(8):968
-983.
ABSTRACT
30. Writing Team for the Diabetes Control and Complications
Trial/Epidemiology of Diabetes Interventions and Complications Research Group.
Effect of intensive therapy on the microvascular complications of type 1
diabetes mellitus. JAMA.2002; 287(19):2563
-2569.
FREE FULL TEXT
31. UK Prospective Diabetes Study (UKPDS) Group. Intensive
blood-glucose control with sulphonylureas or insulin compared with
conventional treatment and risk of complications in patients with type 2
diabetes (UKPDS 33). Lancet.1998; 352(9131):837
-853.
PUBMED
32. Kohner EM, Stratton IM, Aldington SJ, Holman RR, Matthews DR; UK
Prospective Diabetes Study (IKPDS) Group. Relationship between the severity of
retinopathy and progression to photocoagulation in patients with type 2
diabetes mellitus in the UKPDS (UKPDS 52). Diabet Med.2001; 18(3):178
-184.
PUBMED
33. Shichiri M, Kishikawa H, Ohkubo Y, Wake N. Long-term results of the
Kumamoto Study on optimal diabetes control in type 2 diabetic patients.
Diabetes Care.2000; 23(suppl 2):B21
-B29.
PUBMED
34. Wang PH, Lau J, Chalmers TC. Meta-analysis of effects of intensive
blood-glucose control on late complications of type I diabetes.
Lancet.1993; 341(8856):1306
-1309.
PUBMED
35. Wang PH, Lau J, Chalmers TC. Metaanalysis of the effects of
intensive glycemic control on late complications of type I diabetes mellitus.
Online J Curr Clin Trials. May21
, 1993. Doc No. 60.36. Lauritzen T, Frost-Larsen K, Larsen HW, Deckert T. Two-year
experience with continuous subcutaneous insulin infusion in relation to
retinopathy and neuropathy. Diabetes.1985; 34(suppl 3):74
-79.
ABSTRACT
37. Kroc Collaborative Study Group. Blood glucose control and the
evolution of diabetic retinopathy and albuminuria: a preliminary multicenter
trial. N Engl J Med.1984; 311(6):365
-372.
PUBMED
38. Kroc Collaborative Study Group. Diabetic retinopathy after two
years of intensified insulin treatment: follow-up of the Kroc Collaborative
Study. JAMA.1988; 260(1):37
-41.
FREE FULL TEXT
39. Beck-Nielsen H, Olesen T, Mogensen CE, et al. Effect of near
normoglycemia for 5 years on progression of early diabetic retinopathy and
renal involvement. Diabetes Res.1990; 15(4):185
-190.
PUBMED
40. Olsen T, Richelsen B, Ehlers N, Beck-Nielsen H. Diabetic
retinopathy after 3 years' treatment with continuous subcutaneous insulin
infusion (CSII). Acta Ophthalmol (Copenh).1987; 65(2):185
-189.
PUBMED
41. Reichard P, Berglund B, Britz A, Cars I, Nilsson BY, Rosenqvist U.
Intensified conventional insulin treatment retards the microvascular
complications of insulin-dependent diabetes mellitus (IDDM): the Stockholm
Diabetes Intervention Study (SDIS) after 5 years. J Intern
Med.1991; 230(2):101
-108.
PUBMED
42. Dahl-JØrgensen K, Brinchmann-Hansen O, Hanssen KF, et al.
Effect of near normoglycaemia for two years on progression of early diabetic
retinopathy, nephropathy, and neuropathy: the Oslo study. Br Med J
(Clin Res Ed). 1986;293:1195
-1199.
PUBMED
43. Dahl-JØrgensen K, Brinchmann-Hansen O, Hanssen KF, Sandvik
L, Aagenaes O. Rapid tightening of blood glucose control leads to transient
deterioration of retinopathy in insulin dependent diabetes mellitus: the Oslo
study. Br Med J (Clin Res Ed).1985; 290:811
-815.
PUBMED
44. Brinchmann-Hansen O, Dahl-JØrgensen K, Sand-vik L, Hanssen
KF. Blood glucose concentrations and progression of diabetic retinopathy: the
seven year results of the Oslo study. BMJ.1992; 304(6818):19
-22.
FREE FULL TEXT
45. Diabetes Control and Complications Trial Research Group. The effect
of intensive treatment of diabetes on the development and progression of
long-term complications in insulin-dependent diabetes mellitus. N
Engl J Med.1993; 329(14):977
-986.
PUBMED
46. Ohkubo Y, Kishikawa H, Araki E, et al. Intensive insulin therapy
prevents the progression of diabetic microvascular complications in Japanese
patients with non-insulin-dependent diabetes mellitus: a randomized
prospective 6-year study. Diabetes Res Clin Pract.1995; 28(2):103
-117.
PUBMED
47. Reichard P, Nilsson BY, Rosenqvist U. The effect of long-term
intensified insulin treatment on the development of microvascular
complications of diabetes mellitus. N Engl J Med.1993; 329(5):304
-309.
PUBMED
48. Reichard P, Pihl M, Rosenqvist U, Sule J. Complications in IDDM are
caused by elevated blood glucose level: the Stockholm Diabetes Intervention
Study (SDIS) at 10-year follow up. Diabetologia.1996; 39(12):1483
-1488.
PUBMED
49. Early worsening of diabetic retinopathy in the Diabetes Control and
Complications Trial. Arch Ophthalmol.1998; 116(7):874
-886.
FREE FULL TEXT
50. Egger M, Davey Smith G, Stettler C, Diem P. Risk of adverse effects
of intensified treatment in insulindependent diabetes mellitus: a
meta-analysis. Diabet Med.1997; 14(11):919
-928.
PUBMED
51. Wong TY, Mitchell P. The eye in hypertension [published correction
appears in Lancet. 2007;369(9579):2078].
Lancet.2007; 369(9559):425
-435.
PUBMED
52. Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. Is blood pressure
a predictor of the incidence or progression of diabetic retinopathy?
Arch Intern Med.1989; 149(11):2427
-2432.
FREE FULL TEXT
53. Matthews DR, Stratton IM, Aldington SJ, Holman RR, Kohner EM; UK
Prospective Diabetes Study Group. Risks of progression of retinopathy and
vision loss related to tight blood pressure control in type 2 diabetes
mellitus: UKPDS 69. Arch Ophthalmol.2004; 122(11):1631
-1640.
FREE FULL TEXT
54. Estacio RO, Jeffers BW, Gifford N, Schrier RW. Effect of blood
pressure control on diabetic microvascular complications in patients with
hypertension and type 2 diabetes. Diabetes Care.2000; 23 (suppl 2):B54
-B64.
PUBMED
55. Schrier RW, Estacio RO, Esler A, Mehler P. Effects of aggressive
blood pressure control in normotensive type 2 diabetic patients on
albuminuria, retinopathy and strokes. Kidney Int.2002; 61(3):1086
-1097.
PUBMED
56. Chaturvedi N, Sjolie AK, Stephenson JM, et al; EUCLID Study Group.
Effect of lisinopril on progression of retinopathy in normotensive people with
type 1 diabetes. Lancet.1998; 351(9095):28
-31.
PUBMED
57. Schrier RW, Estacio RO, Jeffers B. Appropriate Blood Pressure
Control in NIDDM (ABCD) trial. Diabetologia.1996; 39(12):1646
-1654.
PUBMED
58. Larsen M, Hommel E, Parving HH, Lund-Andersen H. Protective effect
of captopril on the blood-retina barrier in normotensive insulin-dependent
diabetic patients with nephropathy and background retinopathy.
Graefes Arch Clin Exp Ophthalmol.1990; 228(6):505
-509.
PUBMED
59. Knudsen ST, Bek T, Poulsen PL, Hove MN, Rehling M, Mogensen CE.
Effects of losartan on diabetic maculopathy in type 2 diabetic patients: a
randomized, double-masked study. J Intern Med.2003; 254(2):147
-158.
PUBMED
60. ADVANCE Collaborative Group. ADVANCE–Action in Diabetes and
Vascular Disease: patient recruitment and characteristics of the study
population at baseline. Diabet Med.2005; 22(7):882
-888.
PUBMED
61. SjØlie AK, Porta M, Parving HH, Bilous R, Klein R; DIRECT
Programme Study Group. The DIabetic REtinopathy Candesartan Trials (DIRECT)
Programme: baseline characteristics. J Renin Angiotensin
Aldosterone Syst.2005; 6(1):25
-32.
PUBMED
62. Sen K, Misra A, Kumar A, Pandey RM. Simvastatin retards progression
of retinopathy in diabetic patients with hypercholesterolemia.
Diabetes Res Clin Pract.2002; 56(1):1
-11.
PUBMED
63. Cullen JF, Town SM, Campbell CJ. Double-blind trial of Atromid-S in
exudative diabetic retinopathy. Trans Ophthalmol Soc U
K. 1974;94(2):554
-562.
PUBMED
64. Keech A, Simes RJ, Barter P, et al; FIELD Study Investigators.
Effects of long-term fenofibrate therapy on cardiovascular events in 9795
people with type 2 diabetes mellitus (the FIELD study): randomised controlled
trial. Lancet.2005; 366(9500):1849
-1861.
PUBMED
65. Early Treatment Diabetic Retinopathy Study Research Group. Effects
of aspirin treatment on diabetic retinopathy: ETDRS report number 8.
Ophthalmology.1991; 98(5)(suppl):757
-765.
PUBMED
66. Chew EY, Klein ML, Murphy RP, Remaley NA, Ferris FL. Effects of
aspirin on vitreous/preretinal hemorrhage in patients with diabetes mellitus:
Early Treatment Diabetic Retinopathy Study report no. 20Arch
Ophthalmol.1995; 113(1):52
-55.
FREE FULL TEXT
67. DAMAD Study Group. Effect of aspirin alone and aspirin plus
dipyridamole in early diabetic retinopathy: a multicenter randomized
controlled clinical trial. Diabetes.1989; 38(4):491
-498.
ABSTRACT
68. TIMAD Study Group. Ticlopidine treatment reduces the progression of
nonproliferative diabetic retinopathy. Arch
Ophthalmol.1990; 108(11):1577
-1583.
FREE FULL TEXT
69. PKC-DRS Study Group. The effect of ruboxistaurin on visual loss in
patients with moderately severe to very severe nonproliferative diabetic
retinopathy: initial results of the Protein Kinase C beta inhibitor Diabetic
Retinopathy Study (PKC-DRS) multicenter randomized clinical trial.
Diabetes.2005; 54(7):2188
-2197.
FREE FULL TEXT
70. Aiello LP, Davis MD, Girach A, et al; PKC-DRS2 Group. Effect of
ruboxistaurin on visual loss in patients with diabetic retinopathy.
Ophthalmology.2006; 113(12):2221
-2230.
PUBMED
71. Aiello LP, Davis MD, Girach A, et al; PKC-DMES Study Group. Effect
of ruboxistaurin in patients with diabetic macular edema: thirty-six month
results of the randomized PKC-DMES clinical trial. Arch
Ophthalmol. 2007;124:3
18-324.
72. Sorbinil Retinopathy Trial Research Group. A randomized trial of
sorbinil, an aldose reductase inhibitor, in diabetic retinopathy.
Arch Ophthalmol.1990; 108(9):1234
-1244.
FREE FULL TEXT
73. Gardner TW, Sander B, Larsen ML, et al. An extension of the Early
Treatment Diabetic Retinopathy Study (ETDRS) system for grading of diabetic
macular edema in the Astemizole Retinopathy Trial. Curr Eye
Res.2006; 31(6):535
-547.
PUBMED
74. Grant MB, Mames RN, Fitzgerald C, et al. The efficacy of octreotide
in the therapy of severe nonproliferative and early proliferative diabetic
retinopathy: a randomized controlled study. Diabetes
Care.2000; 23(4):504
-509.
ABSTRACT
75. Thomason MJ, Colhoun HM, Livingstone SJ, et al; CARDS
Investigators. Baseline characteristics in the Collaborative AtoRvastatin
Diabetes Study (CARDS) in patients with type 2 diabetes. Diabet
Med. 2004;21
(8): 901-905.
PUBMED
76. Colhoun HM, Betteridge DJ, Durrington PN, et al; CARDS
Investigators. Primary prevention of cardiovascular disease with atorvastatin
in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS):
multicentre randomised placebocontrolled trial.
Lancet.2004; 364(9435):685
-696.
PUBMED
77. Knopp RH, d'Emden M, Smilde JG, Pocock SJ. Efficacy and safety of
atorvastatin in the prevention of cardiovascular end points in subjects with
type 2 diabetes: the Atorvastatin Study for Prevention of Coronary Heart
Disease Endpoints in non-insulindependent diabetes mellitus (ASPEN).
Diabetes Care.2006; 29(7):1478
-1485.
FREE FULL TEXT
78. Aiello LP, Davis MD, Milton RC, Sheetz MJ, Arora V, Vignati L IV.
Protein kinase C inhibitor trials: diabetic retinopathy & diabetic macular
edema. 2005.
http://eyephoto.ophth.wisc.edu/PresentationsPublications/PKCInhibitorTrials.pdf.
Accessed April 4, 2006.79. Ray BS, Pazianos AG, Greenberg E, Peretz WL, McLean JM. Pituitary
ablation for diabetic retinopathy, I: results of hypophysectomy: (a ten-year
evaluation). JAMA.1968; 203(2):79
-84.
FREE FULL TEXT
80. Hardy J, Ciric IS. Selective anterior hypophysectomy in the
treatment of diabetic retinopathy: a transsphenoidal microsurgical technique.
JAMA.1968; 203(2):73
-78.
FREE FULL TEXT
81. Sönksen PH, Russell-Jones D, Jones RH. Growth hormone and
diabetes mellitus: a review of sixtythree years of medical research and a
glimpse into the future? Horm Res.1993; 40(1-3):68
-79.
PUBMED
82. Kirkegaard C, NØrgaard K, Snorgaard O, Bek T, Larsen M,
Lund-Andersen H. Effect of one year continuous subcutaneous infusion of a
somatostatin analogue, octreotide, on early retinopathy, metabolic control and
thyroid function in type I (insulindependent) diabetes mellitus.
Acta Endocrinol (Copenh).1990; 122(6):766
-772.
FREE FULL TEXT
83. Extension Study of the Long-Term Safety and Tolerability of
Octreotide Acetate in Patients With Moderately Severe or Severe
Non-Proliferative Diabetic Retinopathy or Low Risk Diabetic Retinopathy
[NCT00248157].
http://clinicaltrials.gov/ct/show/NCT00248157.
Accessibility verified July 19, 2007.84. Extension Study of the Long-Term Safety and Tolerability of
Octreotide Acetate in Patients With Moderately Severe or Severe
Non-Proliferative Diabetic Retinopathy or Low Risk Diabetic Retinopathy
[NCT00248131].
http://clinicaltrials.gov/ct/show/NCT00248131.
Accessibility verified July 19, 2007.85. Grant MB. Diabetic retinopathy:diagnostic and treatment
novelties. Presented at: American Diabetes Association 66th Scientific
Sessions; June 9-13, 2006; Washington,
DC.86. Photocoagulation treatment of proliferative diabetic retinopathy:
the second report of diabetic retinopathy study findings.
Ophthalmology.1978; 85 (1):82
-106.
PUBMED
87. Rohan TE, Frost CD, Wald NJ. Prevention of blindness by screening
for diabetic retinopathy: a quantitative assessment.
BMJ.1989; 299(6709):1198
-1201.
FREE FULL TEXT
88. Diabetic Retinopathy Study Research Group. Photocoagulation
treatment of proliferative diabetic retinopathy: clinical application of
Diabetic Retinopathy Study (DRS) findings: DRS Report Number 8.
Ophthalmology.1981; 88(7):583
-600.
PUBMED
89. Early Treatment Diabetic Retinopathy Study Research Group. Early
photocoagulation for diabetic retinopathy: ETDRS report number 9.
Ophthalmology.1991; 98(5)(suppl):766
-785.
PUBMED
90. Flynn HW, Chew EY, Simons BD, Barton FB, Remaley NA, Ferris FL;
Early Treatment Diabetic Retinopathy Study Research Group. Pars plana
vitrectomy in the Early Treatment Diabetic Retinopathy Study: ETDRS report
number 17. Ophthalmology.1992; 99(9):1351
-1357.
PUBMED
91. Photocoagulation for proliferative diabetic retinopathy: a
randomised controlled clinical trial using the xenon-arc.
Diabetologia.1984; 26(2):109
-115.
PUBMED
92. British Multicentre Study Group. Photocoagulation for diabetic
maculopathy: a randomized controlled clinical trial using the xenon arc.
Diabetes.1983; 32(11):1010
-1016.
ABSTRACT
93. Hercules BL, Gayed II, Lucas SB, Jeacock J. Peripheral retinal
ablation in the treatment of proliferative diabetic retinopathy: a three-year
interim report of a randomised, controlled study using the argon laser.
Br J Ophthalmol.1977; 61(9):555
-563.
FREE FULL TEXT
94. Patz A, Schatz H, Berkow JW, Gittelsohn AM, Ticho U. Macular
edema:an overlooked complication of diabetic retinopathy. Trans Am
Acad Ophthalmol Otolaryngol.1973; 77(1):OP34
-OP42.
PUBMED
95. Lo'vestam-Adrian M, Agardh CD, Torffvit O, Agardh E. Type 1
diabetes patients with severe non-proliferative retinopathy may benefit from
panretinal photocoagulation. Acta Ophthalmol Scand.2003; 81(3):221
-225.
PUBMED
96. Early Treatment Diabetic Retinopathy Study Research Group.
Photocoagulation for diabetic macular edema: Early Treatment Diabetic
Retinopathy Study report number 1. Arch Ophthalmol.1985; 103(12):1796
-1806.
FREE FULL TEXT
97. Fong DS, Strauber SF, Aiello LP, et al; Writing Committee for the
Diabetic Retinopathy Clinical Research Network. Comparison of the modified
early treatment diabetic retinopathy study and mild macular grid laser
photocoagulation strategies for diabetic macular edema. Arch
Ophthalmol.2007; 125(4):469
-480.
FREE FULL TEXT
98. Blankenship GW. Diabetic macular edema and argon laser
photocoagulation: a prospective randomized study.
Ophthalmology.1979; 86(1):69
-78.
PUBMED
99. Olk RJ. Modified grid argon (blue-green) laser photocoagulation for
diffuse diabetic macular edema. Ophthalmology.1986; 93(7):938
-950.
PUBMED
100. Photocoagulation in treatment of diabetic maculopathy: interim
report of a multicentre controlled study. Lancet.1975; 2(7945):1110
-1113.
PUBMED
101. Ladas ID, Theodossiadis GP. Long-term effectiveness of modified
grid laser photocoagulation for diffuse diabetic macular edema.
Acta Ophthalmol (Copenh).1993; 71(3):393
-397.
PUBMED
102. Early Treatment Diabetic Retinopathy Study design and baseline
patient characteristics: ETDRS report number 7.
Ophthalmology.1991; 98(5)(suppl):741
-756.
PUBMED
103. Pahor D. Visual field loss after argon laser panretinal
photocoagulation in diabetic retinopathy: full-versus mild-scatter
coagulation. Int Ophthalmol.1998; 22(5):313
-319.
PUBMED
104. Buckley SA, Jenkins L, Benjamin L. Fields, DVLC and panretinal
photocoagulation. Eye.1992; 6(pt 6):623
-625.
PUBMED
105. Aiello LM. Perspectives on diabetic retinopathy. Am J
Ophthalmol.2003; 136(1):122
-135.
PUBMED
106. Early Treatment Diabetic Retinopathy Study Research Group. Focal
photocoagulation treatment of diabetic macular edema: relationship of
treatment effect to fluorescein angiographic and other retinal characteristics
at baseline: ETDRS report no. 19Arch Ophthalmol.1995; 113(9):1144
-1155.
FREE FULL TEXT
107. Diabetic Retinopathy Vitrectomy Study Research Group. Early
vitrectomy for severe vitreous hemorrhage in diabetic retinopathy: two-year
results of a randomized trial: Diabetic Retinopathy Vitrectomy Study report 2.
Arch Ophthalmol.1985; 103(11):1644
-1652.
FREE FULL TEXT
108. Early vitrectomy for severe vitreous hemorrhage in diabetic
retinopathy: four-year results of a randomized trial: Diabetic Retinopathy
Vitrectomy Study report 5. Arch Ophthalmol.1990; 108(7):958
-964.
FREE FULL TEXT
109. Gillies MC, Sutter FK, Simpson JM, Larsson J, Ali H, Zhu M.
Intravitreal triamcinolone for refractory diabetic macular edema: two-year
results of a double-masked, placebo-controlled, randomized clinical trial.
Ophthalmology.2006; 113(9):1533
-1538.
PUBMED
110. Pearson, Levy, Comstock; Fluocinolone Acetonide Implant Study
Group. Fluocinolone acetonide intravitreal implant to treat diabetic macular
edema: 3–year results of a multi-center clinical trial.
Invest Ophthalmol Vis Sci.2006; (1).111. Yanyali A, Horozoglu F, Celik E, Ercalik Y, Nohutcu AF. Pars plana
vitrectomy and removal of the internal limiting membrane in diabetic macular
edema unresponsive to grid laser photocoagulation. Eur J
Ophthalmol.2006; 16(4):573
-581.
PUBMED
112. Thomas D, Bunce C, Moorman C, Laidlaw DA. A randomised controlled
feasibility trial of vitrectomy versus laser for diabetic macular oedema.
Br J Ophthalmol.2005; 89(1):81
-86.
FREE FULL TEXT
113. Dhingra N, Sahni J, Shipley J, et al. Vitrectomy and internal
limiting membrane (ILM) removal for diabetic macular edema in eyes with absent
vitreo-macular traction fails to improve visual acuity: results of a 12 months
prospective randomized controlled clinical trial [e-abstract 1467]. Invest
Ophthalmol Vis Sci.
http://abstracts.iovs.org.
Accessibility verified August 3, 2007.114. Bahadir M, Ertan A, Merto lu O. Visual acuity comparison of
vitrectomy with and without internal limiting membrane removal in the
treatment of diabetic macular edema. Int Ophthalmol.2005; 26(1-2):3
-8.
PUBMED
115. Ho T, Smiddy WE, Flynn HW. Vitrectomy in the management of diabetic
eye disease. Surv Ophthalmol.1992; 37(3):190
-202.
PUBMED
116. Diabetic Retinopathy Vitrectomy Study Research Group. Early
vitrectomy for severe proliferative diabetic retinopathy in eyes with useful
vision: results of a randomized trial:Diabetic Retinopathy Vitrectomy Study
report 3. Ophthalmology.1988; 95(10):1307
-1320.
PUBMED
117. Diabetic Retinopathy Vitrectomy Study Research Group. Early
vitrectomy for severe proliferative diabetic retinopathy in eyes with useful
vision: clinical application of results of a randomized trial: Diabetic
Retinopathy Vitrectomy Study report 4. Ophthalmology.1988; 95(10):1321
-1334.
PUBMED
118. Smiddy WE, Flynn HW. Vitrectomy in the management of diabetic
retinopathy. Surv Ophthalmol.1999; 43(6):491
-507.
PUBMED
119. Early Treatment Diabetic Retinopathy Study Research Group.
Treatment techniques and clinical guidelines for photocoagulation of diabetic
macular edema: Early Treatment Diabetic Retinopathy Study Report Number 2.
Ophthalmology.1987; 94(7):761
-774.
PUBMED
120. Akduman L, Olk RJ. Diode laser (810 nm) versus argon green (514 nm)
modified grid photocoagulation for diffuse diabetic macular edema.
Ophthalmology.1997; 104(9):1433
-1441.
PUBMED
121. Canning C, Polkinghorne P, Ariffin A, Gregor Z. Panretinal laser
photocoagulation for proliferative diabetic retinopathy: the effect of laser
wavelength on macular function. Br J Ophthalmol.1991; 75(10):608
-610.
FREE FULL TEXT
122. Akduman L, Olk RJ. Subthreshold (invisible) modified grid diode
laser photocoagulation in diffuse diabetic macular edema (DDME)
Ophthalmic Surg Lasers.1999; 30(9):706
-714.
PUBMED
123. La Heij EC, Hendrikse F, Kessels AG, Derhaag PJ. Vitrectomy results
in diabetic macular oedema without evident vitreomacular traction.
Graefes Arch Clin Exp Ophthalmol.2001; 239(4):264
-270.
PUBMED
124. Dillinger P, Mester U. Vitrectomy with removal of the internal
limiting membrane in chronic diabetic macular oedema. Graefes Arch
Clin Exp Ophthalmol.2004; 242(8):630
-637.
PUBMED
125. Yang CM. Surgical treatment for severe diabetic macular edema with
massive hard exudates. Retina.2000; 20(2):121
-125.
PUBMED
126. Kralinger MT, Pedri M, Kralinger F, Troger J, Kieselbach GF.
Long-term outcome after vitrectomy for diabetic macular edema.
Ophthalmologica.2006; 220(3):147
-152.
PUBMED
127. Stolba U, Binder S, Gruber D, Krebs I, Aggermann T, Neumaier B.
Vitrectomy for persistent diffuse diabetic macular edema. Am J
Ophthalmol.2005; 140(2):295
-301.
PUBMED
128. Yanyali A, Nohutcu AF, Horozoglu F, Celik E. Modified grid laser
photocoagulation versus pars plana vitrectomy with internal limiting membrane
removal in diabetic macular edema. Am J Ophthalmol.2005; 139(5):795
-801.
PUBMED
129. Sobrin L, D'Amico DJ. Controversies in intravitreal triamcinolone
acetonide use. Int Ophthalmol Clin.2005; 45(4):133
-141.
PUBMED
130. Jonas JB, So'fker A. Intraocular injection of crystalline
cortisone as adjunctive treatment of diabetic macular edema. Am J
Ophthalmol.2001; 132(3):425
-427.
PUBMED
131. Jonas JB, Kreissig I, So'fker A, Degenring RF. Intravitreal
injection of triamcinolone for diffuse diabetic macular edema. Arch
Ophthalmol. 2003;121
(1): 57-61.
FREE FULL TEXT
132. Martidis A, Duker JS, Greenberg PB, et al. Intravitreal
triamcinolone for refractory diabetic macular edema.
Ophthalmology.2002; 109(5):920
-927.
PUBMED
133. Avitabile T, Longo A, Reibaldi A. Intravitreal triamcinolone
compared with macular laser grid photocoagulation for the treatment of cystoid
macular edema. Am J Ophthalmol.2005; 140(4):695
-702.
PUBMED
134. Kang SW, Sa HS, Cho HY, Kim JI. Macular grid photocoagulation after
intravitreal triamcinolone acetonide for diffuse diabetic macular edema.
Arch Ophthalmol.2006; 124(5):653
-658.
FREE FULL TEXT
135. Jonas JB, Kamppeter BA, Harder B, Vossmer-baeumer U, Sauder G,
Spandau UH. Intravitreal triamcinolone acetonide for diabetic macular edema: a
prospective, randomized study. J Ocul Pharmacol Ther.2006; 22(3):200
-207.
PUBMED
136. Massin P, Audren F, Haouchine B, et al. Intravitreal triamcinolone
acetonide for diabetic diffuse macular edema: preliminary results of a
prospective controlled trial. Ophthalmology.2004; 111(2):218
-224.
PUBMED
137. Audren F, Erginay A, Haouchine B, et al. Intravitreal triamcinolone
acetonide for diffuse diabetic macular oedema: 6-month results of a
prospective controlled trial. Acta Ophthalmol Scand.2006; 84(5):624
-630.
PUBMED
138. Audren F, Lecleire-Collet A, Erginay A, et al. Intravitreal
triamcinolone acetonide for diffuse diabetic macular edema: phase 2 trial
comparing 4 mg vs 2 mg. Am J Ophthalmol.2006; 142(5):794
-799.
PUBMED
139. Jonas JB, Kreissig I, Spandau UH, Harder B. Infectious and
noninfectious endophthalmitis after intravitreal high-dosage triamcinolone
acetonide. Am J Ophthalmol.2006; 141(3):579
-580.
PUBMED
140. Jonas JB, Degenring RF, Kreissig I, Akkoyun I, Kamppeter BA.
Intraocular pressure elevation after intravitreal triamcinolone acetonide
injection. Ophthalmology.2005; 112(4):593
-598.
PUBMED
141. Gillies MC, Simpson JM, Billson FA, et al. Safety of an
intravitreal injection of triamcinolone: results from a randomized clinical
trial. Arch Ophthalmol.2004; 122(3):336
-340.
FREE FULL TEXT
142. Westfall AC, Osborn A, Kuhl D, Benz MS, Mieler WF, Holz ER. Acute
endophthalmitis incidence: intravitreal triamcinolone. Arch
Ophthalmol. 2005;123
(8): 1075-1077.
FREE FULL TEXT
143. National Eye Institute Clinical Studies Database. A randomized
trial comparing intravitreal triamcinolone acetonide and laser
photocoagulation for dia-lone acetonide and laser photocoagulation for
diabetic macular edema.
http://www.nei.nih.gov/neitrials/viewStudyWeb.aspx?id=105.
Accessed May 2006.144. Spandau UH, Derse M, Schmitz-Valckenber P, Papoulis C, Jonas JB.
Dosage dependency of intravitreal triamcinolone acetonide as treatment for
diabetic macular oedema. Br J Ophthalmol.2005; 89 (8):999
-1003.
FREE FULL TEXT
145. Kuppermann BD, Blumenkranz MS, Haller JA, Williams GA; Posurdex
Study Group. An intravitreous dexamethasone bioerodible drug delivery system
for the treatment of persistent diabetic macular edema [e-abstract 4289].
Invest Ophthalmol Vis Sci.
http://abstracts.iovs.org.
Accessibility verified August 3, 2007.146. Cunningham ET, Adamis AP, Altaweel M, et al; Macugen Diabetic
Retinopathy Study Group. A phase II randomized double-masked trial of
pegaptanib, an anti-vascular endothelial growth factor aptamer, for diabetic
macular edema. Ophthalmology.2005; 112(10):1747
-1757.
PUBMED
147. Adamis AP, Altaweel M, Bressler NM, et al; Macugen Diabetic
Retinopathy Study Group. Changes in retinal neovascularization after
pegaptanib (Macugen) therapy in diabetic individuals.
Ophthalmology.2006; 113(1):23
-28.
PUBMED
148. Brown DM, Kaiser PK, Michels M, et al; ANCHOR Study Group.
Ranibizumab versus verteporfin for neovascular age-related macular
degeneration. N Engl J Med.2006; 355(14):1432
-1444.
PUBMED
149. Rosenfeld PJ, Brown DM, Heier JS, et al; MARINA Study Group.
Ranibizumab for neovascular age-related macular degeneration. N
Engl J Med.2006; 355(14):1419
-1431.
PUBMED
150. Chun DW, Heier JS, Topping TM, Duker JS, Bankert JM. A pilot study
of multiple intravitreal injections of ranibizumab in patients with
center-involving clinically significant diabetic macular edema.
Ophthalmology.2006; 113(10):1706
-1712.
PUBMED
151. Avery RL. Regression of retinal and iris neovascularization after
intravitreal bevacizumab (Avastin) treatment. Retina.2006; 26(3):352
-354.
PUBMED
152. Avery RL, Pearlman J, Pieramici DJ, et al. Intravitreal bevacizumab
(Avastin) in the treatment of proliferative diabetic retinopathy.
Ophthalmology.2006; 113:1695
.
PUBMED
153. Spaide RF, Fisher YL. Intravitreal bevacizumab (Avastin) treatment
of proliferative diabetic retinopathy complicated by vitreous hemorrhage.
Retina.2006; 26(3):275
-278.
PUBMED
154. Rosenfeld PJ. Intravitreal Avastin: the low cost alternative to
Lucentis? Am J Ophthalmol.2006; 142(1):141
-143.
PUBMED
155. Gillies MC. What we don't know about Avastin might hurt us.
Arch Ophthalmol.2006; 124(10):1478
-1479.
FREE FULL TEXT
156. National Eye Institute Clinical Studies Database. A phase 2
evaluation of anti-VEGF therapy for diabetic macular edema: bevacizumab
(Avastin).
http://www.nei.nih.gov/neitrials/viewStudyWeb.aspx?id=129.
Accessibility verified July 23, 2007. lu O. Visual acuity comparison of
vitrectomy with and without internal limiting membrane removal in the
treatment of diabetic macular edema. Int Ophthalmol.2005; 26(1-2):3
-8.
PUBMED
115. Ho T, Smiddy WE, Flynn HW. Vitrectomy in the management of diabetic
eye disease. Surv Ophthalmol.1992; 37(3):190
-202.
PUBMED
116. Diabetic Retinopathy Vitrectomy Study Research Group. Early
vitrectomy for severe proliferative diabetic retinopathy in eyes with useful
vision: results of a randomized trial:Diabetic Retinopathy Vitrectomy Study
report 3. Ophthalmology.1988; 95(10):1307
-1320.
PUBMED
117. Diabetic Retinopathy Vitrectomy Study Research Group. Early
vitrectomy for severe proliferative diabetic retinopathy in eyes with useful
vision: clinical application of results of a randomized trial: Diabetic
Retinopathy Vitrectomy Study report 4. Ophthalmology.1988; 95(10):1321
-1334.
PUBMED
118. Smiddy WE, Flynn HW. Vitrectomy in the management of diabetic
retinopathy. Surv Ophthalmol.1999; 43(6):491
-507.
PUBMED
119. Early Treatment Diabetic Retinopathy Study Research Group.
Treatment techniques and clinical guidelines for photocoagulation of diabetic
macular edema: Early Treatment Diabetic Retinopathy Study Report Number 2.
Ophthalmology.1987; 94(7):761
-774.
PUBMED
120. Akduman L, Olk RJ. Diode laser (810 nm) versus argon green (514 nm)
modified grid photocoagulation for diffuse diabetic macular edema.
Ophthalmology.1997; 104(9):1433
-1441.
PUBMED
121. Canning C, Polkinghorne P, Ariffin A, Gregor Z. Panretinal laser
photocoagulation for proliferative diabetic retinopathy: the effect of laser
wavelength on macular function. Br J Ophthalmol.1991; 75(10):608
-610.
FREE FULL TEXT
122. Akduman L, Olk RJ. Subthreshold (invisible) modified grid diode
laser photocoagulation in diffuse diabetic macular edema (DDME)
Ophthalmic Surg Lasers.1999; 30(9):706
-714.
PUBMED
123. La Heij EC, Hendrikse F, Kessels AG, Derhaag PJ. Vitrectomy results
in diabetic macular oedema without evident vitreomacular traction.
Graefes Arch Clin Exp Ophthalmol.2001; 239(4):264
-270.
PUBMED
124. Dillinger P, Mester U. Vitrectomy with removal of the internal
limiting membrane in chronic diabetic macular oedema. Graefes Arch
Clin Exp Ophthalmol.2004; 242(8):630
-637.
PUBMED
125. Yang CM. Surgical treatment for severe diabetic macular edema with
massive hard exudates. Retina.2000; 20(2):121
-125.
PUBMED
126. Kralinger MT, Pedri M, Kralinger F, Troger J, Kieselbach GF.
Long-term outcome after vitrectomy for diabetic macular edema.
Ophthalmologica.2006; 220(3):147
-152.
PUBMED
127. Stolba U, Binder S, Gruber D, Krebs I, Aggermann T, Neumaier B.
Vitrectomy for persistent diffuse diabetic macular edema. Am J
Ophthalmol.2005; 140(2):295
-301.
PUBMED
128. Yanyali A, Nohutcu AF, Horozoglu F, Celik E. Modified grid laser
photocoagulation versus pars plana vitrectomy with internal limiting membrane
removal in diabetic macular edema. Am J Ophthalmol.2005; 139(5):795
-801.
PUBMED
129. Sobrin L, D'Amico DJ. Controversies in intravitreal triamcinolone
acetonide use. Int Ophthalmol Clin.2005; 45(4):133
-141.
PUBMED
130. Jonas JB, So'fker A. Intraocular injection of crystalline
cortisone as adjunctive treatment of diabetic macular edema. Am J
Ophthalmol.2001; 132(3):425
-427.
PUBMED
131. Jonas JB, Kreissig I, So'fker A, Degenring RF. Intravitreal
injection of triamcinolone for diffuse diabetic macular edema. Arch
Ophthalmol. 2003;121
(1): 57-61.
FREE FULL TEXT
132. Martidis A, Duker JS, Greenberg PB, et al. Intravitreal
triamcinolone for refractory diabetic macular edema.
Ophthalmology.2002; 109(5):920
-927.
PUBMED
133. Avitabile T, Longo A, Reibaldi A. Intravitreal triamcinolone
compared with macular laser grid photocoagulation for the treatment of cystoid
macular edema. Am J Ophthalmol.2005; 140(4):695
-702.
PUBMED
134. Kang SW, Sa HS, Cho HY, Kim JI. Macular grid photocoagulation after
intravitreal triamcinolone acetonide for diffuse diabetic macular edema.
Arch Ophthalmol.2006; 124(5):653
-658.
FREE FULL TEXT
135. Jonas JB, Kamppeter BA, Harder B, Vossmer-baeumer U, Sauder G,
Spandau UH. Intravitreal triamcinolone acetonide for diabetic macular edema: a
prospective, randomized study. J Ocul Pharmacol Ther.2006; 22(3):200
-207.
PUBMED
136. Massin P, Audren F, Haouchine B, et al. Intravitreal triamcinolone
acetonide for diabetic diffuse macular edema: preliminary results of a
prospective controlled trial. Ophthalmology.2004; 111(2):218
-224.
PUBMED
137. Audren F, Erginay A, Haouchine B, et al. Intravitreal triamcinolone
acetonide for diffuse diabetic macular oedema: 6-month results of a
prospective controlled trial. Acta Ophthalmol Scand.2006; 84(5):624
-630.
PUBMED
138. Audren F, Lecleire-Collet A, Erginay A, et al. Intravitreal
triamcinolone acetonide for diffuse diabetic macular edema: phase 2 trial
comparing 4 mg vs 2 mg. Am J Ophthalmol.2006; 142(5):794
-799.
PUBMED
139. Jonas JB, Kreissig I, Spandau UH, Harder B. Infectious and
noninfectious endophthalmitis after intravitreal high-dosage triamcinolone
acetonide. Am J Ophthalmol.2006; 141(3):579
-580.
PUBMED
140. Jonas JB, Degenring RF, Kreissig I, Akkoyun I, Kamppeter BA.
Intraocular pressure elevation after intravitreal triamcinolone acetonide
injection. Ophthalmology.2005; 112(4):593
-598.
PUBMED
141. Gillies MC, Simpson JM, Billson FA, et al. Safety of an
intravitreal injection of triamcinolone: results from a randomized clinical
trial. Arch Ophthalmol.2004; 122(3):336
-340.
FREE FULL TEXT
142. Westfall AC, Osborn A, Kuhl D, Benz MS, Mieler WF, Holz ER. Acute
endophthalmitis incidence: intravitreal triamcinolone. Arch
Ophthalmol. 2005;123
(8): 1075-1077.
FREE FULL TEXT
143. National Eye Institute Clinical Studies Database. A randomized
trial comparing intravitreal triamcinolone acetonide and laser
photocoagulation for dia-lone acetonide and laser photocoagulation for
diabetic macular edema.
http://www.nei.nih.gov/neitrials/viewStudyWeb.aspx?id=105.
Accessed May 2006.144. Spandau UH, Derse M, Schmitz-Valckenber P, Papoulis C, Jonas JB.
Dosage dependency of intravitreal triamcinolone acetonide as treatment for
diabetic macular oedema. Br J Ophthalmol.2005; 89 (8):999
-1003.
FREE FULL TEXT
145. Kuppermann BD, Blumenkranz MS, Haller JA, Williams GA; Posurdex
Study Group. An intravitreous dexamethasone bioerodible drug delivery system
for the treatment of persistent diabetic macular edema [e-abstract 4289].
Invest Ophthalmol Vis Sci.
http://abstracts.iovs.org.
Accessibility verified August 3, 2007.146. Cunningham ET, Adamis AP, Altaweel M, et al; Macugen Diabetic
Retinopathy Study Group. A phase II randomized double-masked trial of
pegaptanib, an anti-vascular endothelial growth factor aptamer, for diabetic
macular edema. Ophthalmology.2005; 112(10):1747
-1757.
PUBMED
147. Adamis AP, Altaweel M, Bressler NM, et al; Macugen Diabetic
Retinopathy Study Group. Changes in retinal neovascularization after
pegaptanib (Macugen) therapy in diabetic individuals.
Ophthalmology.2006; 113(1):23
-28.
PUBMED
148. Brown DM, Kaiser PK, Michels M, et al; ANCHOR Study Group.
Ranibizumab versus verteporfin for neovascular age-related macular
degeneration. N Engl J Med.2006; 355(14):1432
-1444.
PUBMED
149. Rosenfeld PJ, Brown DM, Heier JS, et al; MARINA Study Group.
Ranibizumab for neovascular age-related macular degeneration. N
Engl J Med.2006; 355(14):1419
-1431.
PUBMED
150. Chun DW, Heier JS, Topping TM, Duker JS, Bankert JM. A pilot study
of multiple intravitreal injections of ranibizumab in patients with
center-involving clinically significant diabetic macular edema.
Ophthalmology.2006; 113(10):1706
-1712.
PUBMED
151. Avery RL. Regression of retinal and iris neovascularization after
intravitreal bevacizumab (Avastin) treatment. Retina.2006; 26(3):352
-354.
PUBMED
152. Avery RL, Pearlman J, Pieramici DJ, et al. Intravitreal bevacizumab
(Avastin) in the treatment of proliferative diabetic retinopathy.
Ophthalmology.2006; 113:1695
.
PUBMED
153. Spaide RF, Fisher YL. Intravitreal bevacizumab (Avastin) treatment
of proliferative diabetic retinopathy complicated by vitreous hemorrhage.
Retina.2006; 26(3):275
-278.
PUBMED
154. Rosenfeld PJ. Intravitreal Avastin: the low cost alternative to
Lucentis? Am J Ophthalmol.2006; 142(1):141
-143.
PUBMED
155. Gillies MC. What we don't know about Avastin might hurt us.
Arch Ophthalmol.2006; 124(10):1478
-1479.
FREE FULL TEXT
156. National Eye Institute Clinical Studies Database. A phase 2
evaluation of anti-VEGF therapy for diabetic macular edema: bevacizumab
(Avastin).
http://www.nei.nih.gov/neitrials/viewStudyWeb.aspx?id=129.
Accessibility verified July 23, 2007.
ARTICLE EN RAPPORT
JAMA. 2007;298:837.
Texte Complet
|