 |
 |

Antibiotique et corticostéroïde topique nasal dans le traitement de la sinusite maxillaire aiguëUne étude contrôlée randomisée
Ian G. Williamson, MD;
Kate Rumsby, BA;
Sarah Benge, PhD;
Michael Moore, FRCGP;
Peter W. Smith, PhD;
Martine Cross, BA;
Paul Little, MD
RÉSUMÉ
 |  |
Contexte La sinusite aiguë est un problème clinique
fréquent qui induit généralement la prescription
d'antibiotiques ; cependant, le rôle de ces substances est
controversé. Les anti-inflammatoires comme les
corticostéroïdes topiques peuvent être
bénéfiques, mais n'ont pas été suffisamment
étudiés.
Objectif Déterminer l'efficacité de l'amoxicilline et
du budésonide topique dans la sinusite maxillaire aiguë.
Schéma, cadre et patients Étude factorielle
randomisée, en double aveugle, contrôlée contre placebo,
incluant 240 adultes (âge 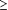 16 ans) avec sinusite aiguë non
récurrente (ayant 16 ans) avec sinusite aiguë non
récurrente (ayant 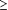 2 critères diagnostiques :
rhinorrhée purulente à prédominance unilatérale,
douleur locale à prédominance unilatérale,
rhinorrhée purulente bilatérale, présence de pus dans la
cavité nasale) dans 58 cabinets de médecins
généralistes (74 praticiens), entre novembre 2001 et novembre
2005. Les patients ont été randomisés dans 1 des 4
groupes de traitement : antibiotique et corticoïde nasal ; antibiotique
placebo et corticoïde nasal ; antibiotique et corticoïde nasal
placebo ; antibiotique placebo et corticoïde nasal placebo. 2 critères diagnostiques :
rhinorrhée purulente à prédominance unilatérale,
douleur locale à prédominance unilatérale,
rhinorrhée purulente bilatérale, présence de pus dans la
cavité nasale) dans 58 cabinets de médecins
généralistes (74 praticiens), entre novembre 2001 et novembre
2005. Les patients ont été randomisés dans 1 des 4
groupes de traitement : antibiotique et corticoïde nasal ; antibiotique
placebo et corticoïde nasal ; antibiotique et corticoïde nasal
placebo ; antibiotique placebo et corticoïde nasal placebo.
Intervention Une dose de 500 mg d'amoxicilline, 3 fois par jour
pendant 7 jours, et 200 µg de budésonide dans chaque narine, une
fois par jour pendant 10 jours.
Principaux critères d'évaluation Proportion de
guérisons cliniques au 10ème jour, selon les carnets
d'autoévaluation des patients, et la durée et la
sévérité des symptômes.
Résultats Les proportions de patients avec des
symptômes durant 10 jours ou plus étaient de 29 sur 100 (29 %)
dans les groupes de traitement avec amoxicilline vs 36 sur 107 (33,6 %) dans
les groupes sans amoxicilline (rapport de cotes ajusté, 0,99 ;
intervalle de confiance à 95 %, 0,57-1,73). Les proportions de patients
avec des symptômes durant 10 jours ou plus étaient de 32 sur 102
(31,4 %) dans les groupes de traitement avec budésonide topique vs 33
sur 105 (31,4 %) dans les groupes sans budésonide (rapport de cotes
ajusté, 0,93 ; intervalle de confiance à 95 %, 0,54-1,62).
L'analyse secondaire suggérait que le corticoïde nasal
était significativement plus efficace chez les patients ayant des
symptômes moins sévères à l'inclusion.
Conclusion Ni l'antibiotique ni le corticostéroïde
topique, seuls ou associés, n'étaient efficaces dans le
traitement de la sinusite aiguë dans le cadre des soins primaires.
Trial Registration
isrctn.org
Identifier: ISRCTN60825437
JAMA.
2007;298(21):2487-2496
Les symptômes à type de sinusite aiguë se
rencontrent fréquemment dans les consultations de soins primaires, et
sont dus à un large groupe d'étiologies
généralement indéfinies au moment de la décision
thérapeutique initiale. Selon les estimations du Royaume-Uni, un
médecin de soins primaires en rencontre 50 cas ou plus par
an.1 Sur l'ensemble
des patients ayant une sinusite maxillaire aiguë (rhinosinusite)
suspectée lors du tableau clinique initial, très peu sont
positivement confirmés par le
médecin.2,3
Des études menées en consultations de soins primaires
suggèrent que 37 % à 63 % de ces patients n'ont pas de
diagnostic
confirmé.4-7
Malgré l'incertitude clinique quant à l'origine
bactérienne de la pathologie en pratique courante, les taux de
prescription d'antibiotiques atteignent 92 % au
Royaume-Uni8 et 85 %
à 98 % aux
États-Unis,9
avec des taux à peine inférieurs aux Pays-Bas (80
%)10 et en
Norvège (67
%).11 Dans la
mesure où il n'existe pas d'études satisfaisantes sur
l'étiologie microbiologique chez des patients typiques de soins
primaires, on assiste très probablement à une
surmédicalisation à grande
échelle.12,13
Les autres questions liées à l'utilisation répandue de
l'antibiothérapie incluent les coûts économiques
associés aux antibiotiques, qui sont actuellement estimés
à environ £ 10 millions par an en termes de prescription au
Royaume-Uni, et de $ 2,4 milliards par an aux
États-Unis,14
ainsi que l'augmentation de la résistance aux antibiotiques dans la
communauté.15
En outre, les patients sous antibiothérapie attribuent la
résolution de leurs symptômes aux antibiotiques (alors que 60
%-85 % des patients dans différents contextes présentent une
amélioration dans un même délai, qu'ils soient ou non
traités pour la
sinusite),16 ce qui
conforte l'opinion quant à leur efficacité. Les cas de sinusite
avec une étiologie bactérienne aiguë sous-jacente
nécessitent une meilleure évaluation diagnostique pour un
ciblage adéquat de l'usage des
antibiotiques.2,17
Le rôle des antibiotiques dans le traitement de la sinusite
aiguë en soins primaires est controversé. La revue Cochrane
suggère des tailles d'effet moyennes des pénicillines dans le
traitement de la sinusite aiguë (pénicilline : réduction du
risque absolu, 5,7 % et nombre de patients à
traiter,18
amoxicilline : réduction du risque absolu, 13,7 % et nombre de patients
à traiter,
8).16 Cependant,
les intervalles de confiance (IC) à 95 % des risques relatifs (RR) pour
les cas guéris indiquent que ces effets ne sont pas significatifs (RR,
1,72 [IC 95 %, 1,00-2,96] pour la pénicilline ; et RR, 2,06 [IC 95 %,
0,65-6,53] pour l'amoxicilline). Les principales données en faveur de
l'utilisation des antibiotiques proviennent de 5 études incluses dans
la revue
Cochrane,16
essentiellement menées dans le cadre de soins secondaires et incluant
des patients avec sinusite confirmée par radiographie. L'extrapolation
de ces résultats à la pratique clinique courante est peu
envisageable, la radiographie n'étant pas utilisée en routine
dans la communauté, où la plupart des cas sont traités et
pris en charge.
Des études sur l'antibiothérapie avec un recrutement des
patients effectué par des médecins de ville tendent à
montrer des tailles d'effets nulles ou inférieures, et les 2
études les mieux notées sur le plan méthodologique (van
Buchem et coll.18
et Lindbaek et
coll.19) sont
parvenues à des conclusions contraires quant à
l'efficacité des antibiotiques. Une récente
revue20 a
suggéré que la plupart des cas de rhinosinusite aiguë se
résolvent avec un traitement symptomatique et des analgésiques,
qui devraient rester la pierre angulaire du traitement. En conséquence,
il n'existe pas de preuves claires ni de consensus permettant de soutenir ou
de réfuter le bénéfice des antibiotiques. Les
études existantes en soins primaires n'ont abouti à aucune
conclusion définitive sur leur efficacité et leur
utilisation.18,19,21-27
La question se pose de savoir si les critères cliniques peuvent
permettre d'axer l'usage des antibiotiques sur les patients plus susceptibles
de présenter une sinusite bactérienne dans la communauté.
Les recommandations de l'Agency for Healthcare Research and Quality
fournissent une revue exhaustive des méthodes
diagnostiques,2
parallèlement à d'autres
études.11,28
Cependant, il existe peu d'études diagnostiques incluant des patients
de divers contextes, qui évaluent spécifiquement les signes et
les symptômes cliniques comparés à la méthode de
culture bactérienne d'échantillons prélevés par
aspiration. Berg et
Carenfelt29 ont
identifié 3 symptômes et 1 signe prédictifs produisant une
courbe ROC (receiver operating characteristic) comparable, sinon
supérieure, à la méthode de radiographie des sinus. Deux
quelconques de ces signes ou symptômes (soit 2 signes et symptômes
sur 4) produisent une sensibilité de 81 %, une
spécificité de 88 % (rapport de vraisemblance pour un
résultat positif de 6,75), et une valeur prédictive positive
moyenne de 86 %, bien que la valeur prédictive positive varie de 63 %
à 91 % en fonction des différentes combinaisons des 4
critères.29
Les corticoïdes intra-nasals ont une action anti-inflammatoire et
potentiellement décongestionnante, produite par l'inhibition de la
transcription des médiateurs pro-inflammatoires et par la stabilisation
des phospholipides membranaires ; il est raisonnable de supposer qu'ils
peuvent avoir un rôle dans le traitement de la sinusite
bactérienne aiguë, par exemple en améliorant la
perméabilité ostiale et en favorisant le drainage des sinus
maxillaires.30 Une
précédente revue avait suggéré que les
corticoïdes topiques n'étaient pas efficaces dans le traitement de
la sinusite
aiguë.30
Cependant, une récente revue
Cochrane31 a
trouvé que pour chaque centaine de patients traités, 7 patients
additionnels obtiendraient des bénéfices des corticoïdes
topiques intranasals ; elle recommandait également la
réalisation d'études complémentaires sur leur
efficacité. Cependant, les échantillons de la revue Cochrane
n'étaient pas typiques des patients de soins
primaires.32-35
Dans 1 vaste
étude32
incluse dans cette revue, les cas étaient sélectionnés
sur un éventail de symptômes initiaux associés à
une probabilité réduite d'origine bactérienne (exclusion
de la douleur sévère localisée ou de la pyrexie), et les
patients étaient inclus sur la base d'une liste de symptômes
à type de sinusite, dont la prédictivité au regard de la
sinusite bactérienne n'est pas démontrée.
Nous rapportons les résultats d'une étude sur
l'efficacité d'un antibiotique (500 mg d'amoxicilline, 3 fois par jour
pendant 7 jours) et d'un corticoïde nasal (200 µg de budésonide
dans chaque narine, une fois par jour pendant 10 jours), seuls ou
associés, dans un groupe de patients consultant en soins primaires et
répondant aux critères cliniques de Berg et
Carenfelt29 pour la
sinusite bactérienne aiguë.
MÉTHODES
Recrutement des médecins
Le plan de recrutement était de 4 patients par médecin (un
bloc randomisé de 4 patients par médecin et 2 médecins
par cabinet). Au total, 117 cabinets ont été visités sur
une période de 2,5 ans, en 2 phases ; 230 médecins
généralistes ont exprimé un intérêt dans
l'étude, mais seuls 74 ont souhaité y participer activement.
Initialement, tous les cabinets des environs étaient invités
à participer jusqu'à ce que l'objectif de 40 cabinets
participants soit atteint. Pour compenser un recrutement initial plus lent que
prévu, 18 cabinets médicaux supplémentaires ont
été inclus dans l'étude par une deuxième phase de
publicité directe et de visites de cabinets, dans un
périmètre plus étendu. Les médecins
généralistes recevaient $ 50 d'indemnisation par patient
recruté, provenant de fonds gouvernementaux ; les patients, en
revanche, ne recevaient aucune indemnisation.
Critères d'inclusion
Les patients adultes, âgés de plus de 15 ans, avec une maladie
aiguë non compliquée (< 28 jours en durée), qui se
présentaient à une consultation de soins primaires avec des
symptômes de sinusite étaient inclus. Le médecin recruteur
vérifiait la présence de 3 symptômes et d'1 signe
clinique, selon les critères de Berg et
Carenfelt29 :
écoulement nasal purulent à prédominance
unilatérale, douleur locale à prédominance
unilatérale, écoulement nasal purulent bilatéralement, et
présence de pus à l'examen nasal. Les patients devaient
être positifs à un minimum de 2 des critères
susmentionnés pour être inclus dans l'étude. La
radiographie des sinus n'a pas été utilisée parce qu'elle
n'est pas préconisée en routine dans les recommandations
cliniques du RU, parce qu'elle n'y est pas utilisée en pratique
courante, parce qu'elle n'est pas supérieure aux critères de
Berg et Carenfelt, et parce qu'elle a un coût
prohibitif.36
Les médecins recevaient une formation informelle, dispensée
par l'investigateur principal ou par des personnes formées par
l'investigateur principal, relative à l'interprétation des
critères d'inclusion et aux techniques d'examen appropriées ;
ils recevaient en outre la visite d'au moins 1 membre de l'équipe de
recherche clinique, qui constituait l'occasion de poser des questions sur
l'étude et sur ses méthodes avant le démarrage.
Critères d'exclusion
Les patients avec une faible probabilité de sinusite
bactérienne aiguë, qui présentaient moins de 2
critères de Berg et Carenfelt, étaient exclus. Dans la mesure
où l'étude était axée sur les patients avec une
pathogenèse bactérienne
primaire,17 ceux
ayant une histoire de sinusite récurrente (définie par 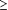 2
crises de sinusite aiguë dans les 12 mois précédents)
étaient exclus. Cette mesure était destinée à
exclure une proportion significative de cas avec une cause allergique
sous-jacente, ou avec une suspicion de pathologie nasale grave sous-jacente,
nécessitant un traitement médicamenteux immédiat ou une
intervention chirurgicale. Les autres critères d'exclusion comprenaient
les comorbidités significatives, telles qu'un diabète mal
contrôlé ou une insuffisance cardiaque, la grossesse ou
l'allaitement, les allergies ou une histoire de réactions
indésirables à l'un des deux médicaments, et la prise
d'antibiotiques ou de corticostéroïdes au cours du mois
précédent. 2
crises de sinusite aiguë dans les 12 mois précédents)
étaient exclus. Cette mesure était destinée à
exclure une proportion significative de cas avec une cause allergique
sous-jacente, ou avec une suspicion de pathologie nasale grave sous-jacente,
nécessitant un traitement médicamenteux immédiat ou une
intervention chirurgicale. Les autres critères d'exclusion comprenaient
les comorbidités significatives, telles qu'un diabète mal
contrôlé ou une insuffisance cardiaque, la grossesse ou
l'allaitement, les allergies ou une histoire de réactions
indésirables à l'un des deux médicaments, et la prise
d'antibiotiques ou de corticostéroïdes au cours du mois
précédent.
Taille de l'échantillon et considérations éthiques
En utilisant la méta-analyse de Cochrane pour un effet de
l'amoxicilline avec 42,5 % de patients traités non guéris vs
61,4 % non traités non guéris, nous avons
déterminé qu'un minimum de 208 patients avec des données
complètes était nécessaire pour un seuil  de 0,05
et un seuil β de 0,20.16 Cette taille d'échantillon ( de 0,05
et un seuil β de 0,20.16 Cette taille d'échantillon ( 200)
devait nous permettre de détecter une différence d'ET de 0,4
(une petite taille d'effet) sur le score total de
sévérité des symptômes (TSS) (une variable continue
plus sensible). Une limite supérieure de 290 patients était
nécessaire pour obtenir un seul β de 0,10. 200)
devait nous permettre de détecter une différence d'ET de 0,4
(une petite taille d'effet) sur le score total de
sévérité des symptômes (TSS) (une variable continue
plus sensible). Une limite supérieure de 290 patients était
nécessaire pour obtenir un seul β de 0,10.
L'étude a été approuvée par le comité
d'éthique régional du sud-ouest de l'Angleterre et par plusieurs
comités d'éthique locaux du sud du pays : Southampton et
Southwest Wiltshire, Île de Wight, Portsmouth, Southeast Hampshire, West
& East Dorset, et North & Mid-Hampshire. Les patients ont donné
leur consentement éclairé écrit aux médecins
après avoir lu la notice d'information du patient et posé leurs
questions.
Plan factoriel
La méthode la plus efficace pour tester plus d'une hypothèse
est l'analyse
factorielle.37 Elle
nécessite un plan d'analyse prédéterminé, incluant
les évaluations des interactions des
traitements.38 Les
4 groupes de traitement de cette étude étaient antibiotique
actif et corticoïde topique actif, antibiotique actif et corticoïde
topique placebo, antibiotique placebo et corticoïde topique actif, et
antibiotique placebo et corticoïde topique placebo. L'analyse
combinée a été organisée comme suit : antibiotique
(antibiotique actif et corticoïde topique actif ; antibiotique actif et
corticoïde topique placebo) vs pas d'antibiotique (antibiotique placebo
et corticoïde topique actif ; et antibiotique placebo et corticoïde
topique placebo) (avec ajustement pour les effets d'un corticoïde dans le
modèle), et corticoïde topique (antibiotique actif et
corticoïde topique actif ; antibiotique placebo et corticoïde
topique actif) vs pas de corticoïde topique (antibiotique actif et
corticoïde topique placebo ; antibiotique placebo et corticoïde
topique placebo) (avec ajustement pour les effets d'un antibiotique dans le
modèle).
Randomisation
La randomisation a été effectuée au niveau des
patients lors des consultations initiales, le médecin utilisant des
ensembles d'essais séquencés en aveugle. Cette configuration
permettait de garantir l'applicabilité des résultats à la
pratique courante (soins primaires/consultations de
généralistes). Les enveloppes numérotées, opaques
et scellées, contenaient les instructions des médecins et les
médicaments actifs ou placebo qui étaient distribués en
charges séparées aux cabinets participants par blocs
randomisés de 4. Ni l'antibiotique ni le flacon pulvérisateur de
corticoïde nasal, actifs et placebos, n'étaient discernables les
uns des autres ; ils étaient en outre identiques de goût et
d'aspect. Les blocs étaient constitués au moyen de tables de
nombres aléatoires, et une personne extérieure à
l'équipe de recherche clinique effectuait la distribution en utilisant
la séquence de nombres aléatoires et le code d'essai. Chaque
bloc randomisé se composait donc d'une séquence pouvant
être auditée des 4 combinaisons possibles des 2 interventions ;
il était notifié aux médecins d'utiliser les blocs par
ordre. Le code d'insu, placé dans une enveloppe scellée,
était conservé dans un classeur à l'université
tout au long de la période de l'étude.
|
|

|
|
Figure 1.. Organigramme des patients dans l'étude
|
|
|
Les lots de médicaments de l'étude (actifs et placebo) ont
été fournis par 2 fabricants de génériques (CTS,
Craigavon, Irlande du Nord, amoxicilline et placebo ; et Generics UK,
Hertfordshire, Angleterre, budésonide et placebo). Tous les emballages
de médicaments, de même que les matériels de
l'étude, n'étaient identifiables que par le numéro de
code de randomisation. Pendant les 4 années de l'étude, aucun
événement indésirable grave ni hospitalisation
associée n'ont été rapportés, et l'unique
enveloppe de décodage n'a été ouverte qu'après
l'achèvement du recueil de toutes les données et
l'enregistrement de toutes les variables dans la base de données.
Après obtention du consentement éclairé écrit
des patients, les médecins ont rempli un questionnaire initial incluant
les signes cliniques, et ont confirmé les critères d'inclusion.
Un examen physique de base, incluant la prise de température, la
palpation des sinus, et l'examen de la partie antérieure de la
cavité nasale (rhinoscopie antérieure), a été
effectué, et les résultats consignés par écrit.
Les données sur la durée des symptômes et la
sévérité de la douleur étaient
enregistrées, et les exclusions confirmées. En outre, certaines
données démographiques initiales ont été
recueillies. Tous les participants ayant accepté d'être
randomisés ont reçu des instructions pour remplir un carnet
d'autoévaluation des symptômes sur 14 jours, les données
devant être complétées chaque jour, ainsi qu'un
questionnaire. Les patients recevaient également des instructions
écrites et illustrées sur le mode d'administration des
médicaments.
Critères d'évaluation et recueil des données
Le principal critère d'évaluation était obtenu
à partir d'un carnet d'autoévaluation. Ce carnet incluait 11
variables relatives aux symptômes, évaluées sur des
échelles de Likert de 7 points et validées dans des
études pragmatiques similaires menées en soins primaires, ainsi
que dans des études diagnostiques de notre
groupe.13,39-41
Les variables du carnet étaient (1) l'obstruction nasale
côté gauche, (2) l'obstruction nasale côté droit,
(3) l'écoulement nasal (narine gauche), (4) l'écoulement nasal
(narine droite), (5) un goût ou une odeur désagréable, (6)
la douleur faciale côté gauche, (7) la douleur faciale
côté droit, (8) la douleur crânienne, maxillaire ou
dentaire à la flexion, (9) le degré de handicap dans les
activités quotidiennes, (10) le niveau de bien-être, et (11) les
céphalées. Chaque variable était notée 0 pour
normal ou absence d'affection, 1 pour une affection très minime, 2 pour
une affection bénigne, 3 pour une affection moyenne, 4 pour une forte
affection, 5 pour une très forte affection, et 6 pour une affection
aussi intense que possible.
Ces carnets étaient combinés avec un questionnaire portant
sur d'autres variables, comme les caractéristiques cliniques et le
degré de satisfaction par rapport à la consultation. Les
patients étaient contactés par téléphone au cours
de la première semaine par un assistant de recherche clinique utilisant
un bref entretien structuré ; il répondait aux questions pour
encourager l'observance et améliorer la qualité des retours de
carnets. Lorsque les patients avaient un score de 0 pour tous leurs
symptômes ou à 2 semaines, il leur était demandé de
retourner le carnet complété par courrier, accompagné des
échantillons d'antibiotiques non utilisés (pour comptage) et du
pulvérisateur nasal (pour pesage). Les patients qui ne
répondaient pas étaient recontactés par
téléphone ou par courrier afin d'encourager les retours. Pour
certains des non-répondants, les données nécessaires
à l'étude ont pu être recueillies par le biais d'un
entretien téléphonique (n = 14, soit 5,8 % de la population
randomisée). Cette méthode a été validée
précédemment par notre
groupe.39-41
Les médecins tenaient également des cahiers sur les cas non
inclus quand cela était possible, et sur les motifs des refus. Les
notes étaient analysées lors de retours en consultation
associés à 6 semaines. Toutes les évaluations des
critères ont été enregistrées sur une base de
données centrale et vérifiées si nécessaire par un
membre de l'équipe de recherche, aveugle au groupe de traitement
attribué.
Analyse statistique
Tous les patients ayant rempli leur carnet (n = 207) ont été
analysés en fonction du groupe de traitement auquel ils étaient
assignés, indépendamment de l'observance. Notre analyse
principale n'utilisait pas d'imputation des données en cas
d'informations manquantes sur la résolution des symptômes
(réduction des symptômes à un niveau minimum ou absence de
problème), compte tenu de l'absence de base pour estimer la date de
résolution des symptômes chez ces patients. Cependant, les
analyses de sensibilité ont été effectuées en
aveugle selon 2 méthodes : avec imputation de données (en
supposant que les perdus de vue étaient toujours symptomatiques au
14ème jour), et avec et sans les informations supplémentaires
obtenues par téléphone. Nous n'avons trouvé aucune
différence significative dans les résultats. Toutes ces analyses
et les suivantes ont été effectuées conformément
au plan d'analyse prédéfini. Nous avons suivi les règles
d'analyse statistique relatives aux études
factorielles,38 et
n'avons observé aucune interaction significative entre les traitements
pour toutes les données rapportées.
Une méthode de régression logistique a été
utilisée pour la variable primaire dichotomique (proportion de patients
guéris vs patients avec symptômes persistant 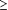 10 jours). La
régression de Cox a également été utilisée
pour analyser la résolution des symptômes. Les hypothèses
des risques proportionnels ont été évaluées
graphiquement, ainsi qu'en comparaison avec les courbes de Kaplan-Meier,
présentées avec les résultats du test du log-rank.
Lorsqu'aucune donnée relative aux symptômes n'était
disponible, les données étaient censurées dans les
courbes de Kaplan-Meier. Un modèle non paramétrique de
régression sur quantile a été utilisé pour les
scores des variables continues. Le modèle de la moindre valeur absolue
de Stata (StataCorp, College Station, Texas) a été
utilisé dans la régression sur quantile pour estimer les
médianes. La régression médiane permet de
déterminer le plan de régression qui minimise la somme des
résidus absolus plutôt que la somme des carrés des
résidus. L'analyse était conforme au plan factoriel
(c'est-à-dire que les effets principaux de chaque facteur
étaient couplés aux autres facteurs une fois que nous avions
testé et confirmé l'absence d'interaction entre les groupes de
traitement). 10 jours). La
régression de Cox a également été utilisée
pour analyser la résolution des symptômes. Les hypothèses
des risques proportionnels ont été évaluées
graphiquement, ainsi qu'en comparaison avec les courbes de Kaplan-Meier,
présentées avec les résultats du test du log-rank.
Lorsqu'aucune donnée relative aux symptômes n'était
disponible, les données étaient censurées dans les
courbes de Kaplan-Meier. Un modèle non paramétrique de
régression sur quantile a été utilisé pour les
scores des variables continues. Le modèle de la moindre valeur absolue
de Stata (StataCorp, College Station, Texas) a été
utilisé dans la régression sur quantile pour estimer les
médianes. La régression médiane permet de
déterminer le plan de régression qui minimise la somme des
résidus absolus plutôt que la somme des carrés des
résidus. L'analyse était conforme au plan factoriel
(c'est-à-dire que les effets principaux de chaque facteur
étaient couplés aux autres facteurs une fois que nous avions
testé et confirmé l'absence d'interaction entre les groupes de
traitement).
Les principaux résultats sont présentés en rapports de
cotes ajustés (ORa), en faveur des groupes traitements ou
témoin, avec leur IC 95 %. L'analyse factorielle a également
été utilisée pour définir les groupes de
symptômes majeurs. Après extraction des composantes principales,
une rotation varimax a été appliquée. Elle permet de
préserver l'orthogonalité des axes tout en maximisant la somme
des variances des poids factoriels, de sorte que chaque facteur ait quelques
poids substantiels, le reste étant aussi proche de zéro que
possible. Les interactions entre la sévérité initiale et
les résultats sont rapportées. Les logiciels Stata version 9
(StataCorp) et SPSS version 15 (SPSS Inc, Chicago, Illinois) ont
été utilisés pour l'analyse. La valeur de p < 0,05 a
été utilisée comme seuil de signification.
|
|

|
|
Figure 2.. Courbe de résolution des symptômesa
aDéfini par notation de 0 ou 1 par le patient sur
l'ensemble des 11 items du carnet.
|
|
|
RÉSULTATS
Au total, 388 patients ont été évalués pour
l'inclusion et 240 ont été randomisés, sur une
période d'étude de 4 ans (de novembre 2001 à novembre
2005). La Figure 1
présente l'organigramme des patients dans l'étude. En moyenne, 3
patients ont été recrutés par médecin et 4 par
cabinet (un bloc randomisé de 4 patients). L'une des raisons de la
lenteur du recrutement résidait dans le refus de la randomisation par
certains patients (n = 54), justifié par la nécessité
d'une antibiothérapie immédiate. Cependant, la plupart des
motifs de non-inclusion étaient soit le manque de temps du
médecin pendant les consultations (n = 38 ; ces détails ont
été consignés dans les carnets du médecin et
vérifiés à la fin de l'étude), soit la
présence d'autres critères d'exclusion (n = 32), le plus
fréquent étant l'allergie aux antibiotiques de type
pénicilline, soit la non-réponse des patients aux
critères d'inclusion (n = 24). Selon plusieurs médecins, les
critères d'inclusion utilisés excluaient un nombre significatif
de cas courants de « sinusite » rencontrés dans leur
pratique, confirmant que nos critères étaient plus restrictifs
que ceux habituellement utilisés dans le diagnostic clinique. L'aveugle
a également été évalué, et nous n'avons
trouvé aucune différence significative dans la croyance des
patients en l'efficacité du traitement attribué (échelles
de 0-5) pour les comprimés d'antibiotique vs comprimés placebo
(p = 0,07), comme pour le pulvérisateur de corticostéroïde
vs pulvérisateur placebo (p = 0,25).
Sur les 240 adultes randomisés, âgés de 16 ans ou plus
et répondant aux critères d'inclusion, environ 70 %
présentaient 2 des critères diagnostiques de Berg et
Carenfelt29 ; 30 %
en présentaient 3 ou l'ensemble des 4. L'âge médian
était de 44 ans, et il y avait 4 femmes pour 1 homme. Le
Tableau 1 présente les
caractéristiques initiales des patients par groupe de traitement. Les
facteurs de confusion potentiels sont analysés en fonction des
regroupements factoriels utilisés dans les analyses principales
(Tableau 2). L'âge, le
sexe, l'histoire de tabagisme, l'asthme, l'eczéma, le rhume des foins,
les antécédents de sinusite, la présence de pus à
l'examen, la température initiale, le nombre de jours des
symptômes, et leur sévérité initiale, selon les
critères de Berg et
Carenfelt,29
indiquaient tous l'absence de différence significative entre les
groupes à l'inclusion, à l'exception de la température
entre les patients recevant l'antibiotique et ceux recevant le placebo (p =
0,05). Bien que de manière non significative, les patients recevant
l'antibiotique étaient légèrement moins susceptibles
d'être de sexe masculin (26,5 % vs 28,3 %) et moins susceptibles de
présenter du pus à l'examen (31,9 % vs 39,4 %). La
prévalence de l'atopie dans l'échantillon global était
légèrement supérieure à celle de la population
générale. La présence d'un antécédent
d'atopie ne modifiait pas les estimations ni les conclusions. La
majorité des patients avait un antécédent
d'épisode de sinusite (mais pas 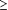 2 épisodes dans les 12 mois
précédents).42
La durée médiane des précédents symptômes
avant consultation d'un médecin était de 7 jours (intervalle
interquartile, 10 jours). 2 épisodes dans les 12 mois
précédents).42
La durée médiane des précédents symptômes
avant consultation d'un médecin était de 7 jours (intervalle
interquartile, 10 jours).
|
|

|
|
Tableau 1.. Comparaison initiale des groupes intervention et témoin
Abréviation : IIQ, intervalle interquartile.
aSauf indication contraire.
|
|
|
|
|

|
|
Tableau 2.. Antibiotique vs Pas d'antibiotique et corticoïde vs pas de
corticoïde
Abréviation: IIQ, intervalle interquartile.
aSauf indication contraire.
bL'intervalle de confiance à 95 % pour la
di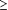 érence intergroupe antibiotique vs pas d'antibiotique est de
-4,87 à 3,02, et de -3,84 à 4,05 pour les groupes
corticoïde vs pas de corticoïde. érence intergroupe antibiotique vs pas d'antibiotique est de
-4,87 à 3,02, et de -3,84 à 4,05 pour les groupes
corticoïde vs pas de corticoïde.
|
|
|
|
|

|
|
Figure 3.. Guérison par antibiotique et corticoïde définie par
Score total de sévérité des symptômes
Les données sont présentées en scores médians
avec intervalles interquartiles (IIQ ; n = 207). Les scores totaux
médians des symptômes sur 10 jours étaient de 10 (IIQ,
2-22) pour les patients ayant reçu l'antibiotique ; 12 (IIQ, 3-25) pour
ceux n'ayant pas reçu d'antibiotique ; 11 (IIQ, 2-24) pour les patients
ayant reçu le corticoïde ; et 11 (IIQ, 2-23) pour ceux n'ayant pas
reçu de corticoïde. Le jour O indique le jour de la
randomisation.
|
|
|
Au total, 33 patients ont été perdus de vue à 2
semaines (13,7 % perdus de vue). Les patients qui présentaient du pus
à l'examen (ORa, 1,50 ; IC 95 %, 0,66-3,40) et qui étaient de
sexe masculin (ORa, 3,75 ; IC 95 %, 1,66-8,48) étaient plus
susceptibles d'être perdus de vue. Les dossiers cliniques ont
confirmé la sortie d'étude de 2 des patients perdus de vue : 1
dans le groupe antibiotique et corticoïde et 1 dans le groupe double
placebo. Ils sont tous deux sortis précocement en raison de
symptômes persistants.
Il n'y avait pas de tests significatifs pour les interactions entre
traitements par groupe factoriel (comprimé d'antibiotique vs
comprimé placebo et pulvérisateur de corticoïde vs
pulvérisateur placebo). Les résultats présentés
ici sont basés sur les données des patients ayant renvoyé
leurs carnets, répondu aux critères (n = 193) et effectué
les entretiens validés (n = 14). La colinéarité et le
surajustement de nos modèles ont été
évalués, mais ni l'un ni l'autre n'ont été
démontrés.
Les proportions de patients ayant des symptômes durant 10 jours ou
plus étaient de 29 sur 100 (29 %) dans les groupes recevant
l'amoxicilline vs 36 sur 107 (33,6 %) dans les groupes sous placebo (ORa, 0,99
; IC 95 %, 0,57-1,73). Les proportions de patients avec des symptômes
durant 10 jours ou plus étaient de 32 sur 102 (31,4 %) dans les groupes
recevant le budésonide topique vs 33 sur 105 (31,4 %) dans les groupes
sans budésonide (ORa, 0,93 ; IC 95 %, 0,54-1,62). La régression
de Cox a confirmé l'absence d'effet significatif de l'amoxicilline
(risque relatif pour la résolution, 1,08 [IC 95 %, 0,79-1,48] ; p =
0,63) et du budésonide (risque relatif, 1,05 [IC 95 %, 0,77-1,44] ; p =
0,75).
Lorsque l'analyse de sensibilité était effectuée en
utilisant une méthode d'imputation pour les valeurs des patients perdus
de vue, les effets estimés de l'amoxicilline sur les symptômes
durant 10 jours ou plus (ORa, 0,90 ; IC 95 %, 0,54-1,50) et du
budésonide (ORA, 0,90 ; IC 95 %, 0,54-1,50) étaient
également non significatifs. La petite différence dans l'effet
apparent de l'antibiotique observée dans cette analyse pourrait
partiellement s'expliquer par un artéfact lié à de
légères différences dans les groupes de randomisation ;
en effet, le groupe placebo incluait davantage d'hommes et de patients
présentant du pus à l'examen, et ces deux variables
étaient prédictives des perdus de vue.
La proportion de guérisons par jour jusqu'à J 14 est
présentée dans la Figure
2 pour les groupes amoxicilline vs placebo et budésonide
topique vs placebo. La guérison pour chaque patient était
définie par la notation d'affection absente ou très
bénigne (0 ou 1) pour les 11 items du carnet, pris
séparément et ensemble. Aucune différence notable
n'était observée dans le délai à la
guérison pour chacun des groupes, 40 % des patients étant
guéris à 1 semaine. La résolution apparaît plus
lente pendant la deuxième semaine (troisième semaine de
maladie).
Le score TSS quotidien était basé sur la somme de toutes les
valeurs numériques des échelles de Likert (pour les jours 0-10).
Pour établir des groupements statistiquement significatifs des
symptômes associés, une analyse en composantes principales a
été effectuée, avec une rotation varimax. Les 2 premiers
sous-groupes de symptômes ont été retenus sur la base des
valeurs propres supérieures à 1. Ils incluaient l'indisposition
(déter- minée par les symptômes 8-11) ;  de
Cronbach = 0,92) et la douleur (symptômes 6-8 ; de
Cronbach = 0,92) et la douleur (symptômes 6-8 ;  = 0,83). = 0,83).
Le score total de sévérité des symptômes
atteignait un maximum de 66 pour les 11 variables. Les données
n'étant pas distribuées normalement pour ces scores, les valeurs
médianes ont été établies au fil du temps pour
chacun des groupes, et sont présentées dans la
Figure 3 pour les groupes
amoxicilline vs placebo et budésonide topique vs placebo. La
régression (quantile) non paramétrique a été
effectuée au 10ème jour. Il n'y avait pas de différence
significative dans les médianes pour les groupes amoxicilline vs
placebo (différence médiane, 0 [IC 95 %, -0,70 à 0,70] ;
p > 0,99) ou budésonide vs placebo (différence
médiane, 0 [IC 95 %, -0,70 à 0,70] ; p > 0,99). Il n'y avait
pas non plus de différence entre les groupes avec l'utilisation du
score TSS moyen pour l'ensemble des 14 jours.
Les groupes des symptômes de douleur et d'indisposition
identifiés par l'analyse factorielle ont été
étudiés séparément en raison de leur importance
pour les médecins dans la prise en charge du patient et pour
l'évaluation de tout effet différentiel des traitements. Pour le
groupe de symptômes de douleur, aucune différence significative
n'a été trouvée entre chacun des groupes pour chaque jour
; la résolution complète de la douleur survenait aux jours 6 ou
7, soit 1 jour avant les autres variables du carnet. Le groupe de
symptômes d'indisposition a été évalué en
utilisant le score moyen de sévérité (score, 0-6) et
était basé sur le degré d'indis- position du patient et
le degré de restriction dans ses activités quotidiennes. Les
interactions entre la sévérité initiale et les groupes de
traitement avec une sévérité à 10 jours ont
ensuite été testées. Une interaction significative entre
la sévérité majorée à l'inclusion et le
corticoïde nasal a été trouvée pour le groupe de
symptômes d'indisposition. En tenant compte de cette interaction,
l'effet du corticoïde sur le groupe de symptômes d'indisposition
à 10 jours était de -0,75 (IC 95 %, -1,34 à -0,14) pour
un score de sévérité initiale de zéro. Cependant,
le coefficient d'interaction était de 0,28 (IC 95 %, 0,10 à 0,45
; p = 0,003 ; c'est-à-dire que l'effet du corticoïde nasal
était réduit de 0,28 pour chaque point d'augmentation dans la
sévérité initiale de la sinusite). Ainsi, l'effet du
corticoïde pour un patient avec un score de sévérité
initiale de 1 est de -0,75+0,28 = -0,47, tandis que pour un patient ayant un
score initial de 3, il est de -0,75+0,28 x 3 = 0,09, et pour un score
initial de 5, de -0,75+0,28 x 5 = 0,65. En conséquence, le
corticoïde nasal a produit un bénéfice clinique chez les
patients ayant des symptômes moins sévères dans notre
échantillon de sinusite bactérienne probable, et des effets
délétères dans les cas de symptômes plus
sévères. Aucun événement indésirable grave
n'est survenu selon les données expérimentales et cliniques, et
l'analyse des cas à 6 semaines.
COMMENTAIRE
À notre connaissance, il s'agit ici de la plus vaste étude
contrôlée contre placebo, randomisée, en double aveugle,
non financée par l'industrie pharmaceu-tique, évaluant
l'efficacité de l'amoxi- cilline chez des patients atteints de sinusite
aiguë (avec des signes typiques de sinusite bactérienne) se
présentant chez des médecins généralistes, et la
seule étude du budésonide suffisamment puissante dans ce groupe
de patients. À partir de nos principaux résultats, nous pouvons
affirmer, avec une certitude de plus de 95 %, que la taille d'effet
rapportée dans la revue
Cochrane16 pour
l'amoxicilline (risque relatif, 2,06) ne concerne pas la population dont notre
échantillon était issu. Si l'on considère conjointement
plusieurs autres études en soins primaires, il apparaît que toute
taille d'effet, en supposant un effet des antibiotiques, est significativement
inférieure à celle rapportée dans la revue
Cochrane,16 qui
incluait les données combinées de populations de soins primaires
et secondaires pour guider ses recommandations. Notre définition plus
rigoureuse de la sinusite peut signifier que des cas moins bien
définis, traités en routine par les médecins en soins
primaires, montreraient encore moins d'effets liés à la prise
d'antibiotiques.
L'une des limites potentielles de l'étude est sa puissance pour
détecter des effets cliniquement bénéfiques de
l'antibiotique, et la possibilité d'un résultat
faux-négatif.16
Selon l'IC 95 % pour la différence dans les proportions, nos
résultats suggèrent que la différence maximale probable
entre les proportions de patients ayant des symptômes pendant 10 jours
ou plus comme bénins vs très bénins ou une durée
globale des symptômes réduite d'1 jour. Bien que nous ayons pu ne
pas détecter des effets minimes, la présence d'un
bénéfice clinique est peu probable, en particulier s'il est
comparé aux inconvénients des antibiotiques.
Une autre limite potentielle de cette étude réside dans le
faible taux d'inclusions (valeur moyenne de 3 patients par médecin
généraliste), bien que le recrutement effectué par les
médecins de notre étude ait été supérieur
à la moyenne dans les études en
communauté.43
L'incidence de la grippe saisonnière était faible sur la
période étudiée (réduisant ainsi la
probabilité de sinusite bactérienne secondaire). Les obstacles
fréquents au recrutement incluaient les pres- sions liées au
travail empêchant les médecins débordés de s'y
consacrer (avec comparativement de faibles taux de remboursement pour le temps
consacré à l'étude), et le caractère restrictif de
nos critères diagnostiques, qui excluaient de nombreux patients. Ceci
suggère que nos résultats devraient néanmoins être
généralisables à la population de patients avec des
critères de Berg et
Carenfelt29
consultant en soins primaires ou chez des médecins
généralistes, et que les effets des antibiotiques seraient
encore plus faibles dans une population moins sélectionnée.
Les critères de Berg et
Carenfelt29 n'ont
pas été validés dans des populations de soins primaires
et sont peu susceptibles de l'être, compte tenu de la nature invasive
des méthodes de référence utilisées (ponction du
sinus).11 Bien
qu'il soit possible que la valeur prédictive positive trouvée
par Berg et Carenfelt (86 %) dans une population de soins secondaires soit
inférieure chez des patients de soins primaires, le rapport de
vraisemblance pour un test positif de 6,75 n'en signifie pas moins que la
plupart des patients ayant les critères de Berg et Carenfelt,
reçus en soins primaires, auront une sinusite bactérienne. Pour
ce rapport de vraisemblance, une probabilité avant le test de 50 %
donne une probabilité après le test d'environ 90 % ; cependant,
même une probabilité avant le test de 20 % donne une
probabilité après le test de 65 % (en utilisant le nomogramme de
Bayes).44 Nous
soutenons l'utilisation des critères de Berg et
Carenfelt29 pour
les raisons suivantes : (1) certaines don- nées démontrent que
la probabilité post-test de 90 % est une approximation
raisonnable11 ; (2)
ils représentent les meilleurs critères disponibles
validés par des médecins (parce qu'ils utilisent la meilleure
méthode de référence d'aspi- ration antrale) ; et (3)
selon les données de l'Agency for Healthcare Research and Quality, ils
sont comparables, voire supérieurs, à d'autres méthodes,
notamment la radiographie.
Le plus important réside sans doute dans le fait que la
radiographie, la tomodensitométrie et la vitesse de
sédimentation érythrocytaire ne sont pas utilisées dans
les consultations de soins primaires du Royaume-Uni avant la décision
thérapeutique (ni dans la plupart des contextes de soins pri- maires),
de sorte que leur utilisation annexe dans cette étude aurait
sérieusement limité la possibilité de
généralisation de nos données dans la communauté,
qui est concernée par la majorité des prescriptions
d'antibiotiques. Nous admettons qu'il existe des variations culturelles dans
l'utilisation de ces tests annexes ; cependant, notre méthode de
recrutement, l'utilisation de critères cliniques standardisés,
et les taux de prescriptions d'antibiotiques similaires observés entre
les États-Unis, le Royaume-Uni et certains pays d'Europe, contribuent
conjointement à conforter la possibilité de
généralisation probable de nos résultats.
Le schéma posologique de 500 mg d'amoxicilline 3 fois par jour
pendant 7 jours est similaire à celui de l'étude menée
par van Buchem et
coll.18 et de
plusieurs autres études en soins
primaires.22-25,27
Il est conforme aux recommandations du Royaume-Uni et des États-Unis en
traitement de première intention, en particulier lorsque l'incidence de
Moraxella est susceptible d'être faible. Trois méta-analyses
n'ont trouvé aucune donnée démontrant la
supériorité d'une classe particulière d'antibiotiques par
rapport aux autres dans la sinusite aiguë
;16,45,46
il est donc peu probable qu'un autre antibiotique aurait produit des
résultats différents. L'absence d'efficacité peut
être due à une mauvaise pénétration dans les
cavités, qui est caractéristique aux antibiotiques.
De même, les corticoïdes topiques semblent n'avoir globalement
aucun effet cliniquement bénéfique dans la population
étudiée. Cependant, une forte interaction entre la
sévérité initiale et le résultat a
été observée pour le corticoïde nasal (p = 0,003),
indiquant que le corticoïde topique nasal a produit des
bénéfices dans les cas plus bénins de
l'échantillon, mais n'en a produit aucun dans les cas plus
sévères. Ainsi, cette étude pourrait être
interprétée comme une corroboration des résultats de
Meltzer et coll.32
concernant l'efficacité des corticoïdes topiques dans la sinusite
aiguë, où la population était définie par une
affection moins sévère et une moindre probabilité
d'infection bactérienne aiguë. Ceci suggère que les
corticoïdes topiques (en raison de leur mode de délivrance local
aux muqueuses) sont plus susceptibles de produire un bénéfice
à un stade précoce de l'histoire naturelle de la maladie, avant
le développement de stades plus réfractaires,
caractérisés par des sécrétions épaisses,
la est de 13,5 % (soit un nombre de patients à traiter 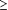 7). Nos
critères d'évaluation continus sont plus sensibles pour
détecter tout effet cliniquement utile (ET de 0,4 ; soit une petite
taille d'effet). En conséquence, nous pouvons être sûrs de
ne pas avoir manqué une différence de 4 points de pourcentage
sur le score TSS, ce qui équivaut approximativement à un tiers
des patients notant leurs symptômes fermeture de l'ostium, et une
inflammation sévère avec signes systémiques. 7). Nos
critères d'évaluation continus sont plus sensibles pour
détecter tout effet cliniquement utile (ET de 0,4 ; soit une petite
taille d'effet). En conséquence, nous pouvons être sûrs de
ne pas avoir manqué une différence de 4 points de pourcentage
sur le score TSS, ce qui équivaut approximativement à un tiers
des patients notant leurs symptômes fermeture de l'ostium, et une
inflammation sévère avec signes systémiques.
Selon nos principales conclusions, ni l'antibiotique ni le corticoïde
topique, seuls ou associés, n'ont d'effet sur la
sévérité des symptômes, la durée ou
l'évolution naturelle de la maladie, chez les patients ayant des signes
typiques de la sinusite bactérienne aiguë.
Les corticoïdes topiques sont susceptibles d'être efficaces chez
les patients présentant ces caractéristiques, mais avec des
symptômes moins sévères à la
présentation.
Informations sur les auteurs
Correspondance : Ian G.Williamson, MD, University of Southampton,
Aldermoor Close, Southampton SO165ST, England
(igw{at}soton.ac.uk).
Contributions des auteurs : Le Dr Williamson a eu un accès
complet à toutes les données de l'étude et accepte la
responsabilité de l'intégrité des données et de
l'exactitude de l'analyse des données.
Conception et schéma de l'étude : Williamson,
Little.
Recueil des données : Williamson, Rumsby, Benge, Moore,
Cross.
Analyse et interprétation des données : Williamson,
Rumsby, Benge, Moore, Smith, Little.
Rédaction du manuscrit : Williamson, Benge, Smith,
Little.
Revue critique du manuscrit : Williamson, Rumsby, Benge, Moore,
Cross, Little.
Analyse statistique : Williamson, Rumsby, Benge, Smith,
Little.
Obtention du financement : Williamson, Little.
Aide administrative, technique et matérielle : Rumsby,
Benge, Moore, Cross.
Supervision de l'étude : Williamson.
Liens financiers : Le Dr Little a déclaré avoir
reçu des honoraires de consultant pour des demi-journées
d'Abbott Pharmaceuticals pour travailler sur le sujet des complications des
infections du tractus respiratoire.
Aucun autre auteur n'a déclaré de liens financiers.
Financement/Soutien : Cette étude a bénéficié
du soutien du UK Department of Health.
Rôle du sponsor : Le UK Department of Health n'a pas
participé au schéma et à la conduite de l'étude,
au recueil, l'analyse et l'interprétation des données, à
la préparation, la revue ou l'approbation du manuscrit.
Autres contributions : Nous remercions pour le financement, le UK
Department of Health, pour leur participations, les patients, et les
médecins et consultations ayant fait les inclusions.
Affiliations des auteurs : Department of Medicine, University of
Southampton, Southampton, England; Southampton Statistical Sciences Research
Institute, Southampton, England; and NightingaleSurgery, Romsey,
England.
BIBLIOGRAPHIE
 |  |
1. Office of Population Census and Surveys. Morbidity
Statistics From General Practice: Fourth National Study 1991.
London, England: Her Majesty's Stationery Office;1994
.
2. Lau J, Zucker D, Engels EA, et al; Agency for Healthcare Research
and Quality. Diagnosis and Treatment of Acute Bacterial
Rhinosinusitis: Evidence Report/Technology Assessment No. 9.
Rockville, MD: Agency for Healthcare Research and Quality;1999
.3. Lund VJ. Rhinosinusitis. Br J Hosp Med.1997; 57(7):308
-312.
PUBMED
4. Lindbaek M, Hjortdal P, Johnsen ULH. Use of symptoms, signs, and
blood tests to diagnose acute sinus infections in primary care: comparison
with computed tomography. Fam Med.1996; 28(3):183
-188.
PUBMED
5. Hansen JG, Schmidt H, Rosborg J, Lund E. Predicting acute maxillary
sinusitis in a general practice population. BMJ.1995; 311(6999):233
-236.
FREE FULL TEXT
6. Williams JW, Simel DL, Roberts L, Samsa GP. Clinical evaluation for
sinusitis: making the diagnosis by history and physical examination.
Ann Intern Med.1992; 117(9):705
-710.
FREE FULL TEXT
7. van Duijn NP, Brouwer HJ, Lamberts H. Use of symptoms and signs to
diagnose maxillary sinusitis in general practice: comparison with
ultrasonography. BMJ.1992; 305(6855):684
-687.
FREE FULL TEXT
8. Ashworth M, Charlton J, Ballard K, Latinovic R, Gulliford M.
Variations in antibiotic prescribing and consultation rates for acute
respiratory infection in UK general practices 1995-2000. Br J Gen
Pract.2005; 55(517):603
-608.
PUBMED
9. Hickner JM, Bartlett JG, Besser RE, Gonzales R, Hoffman JR, Sande
MA. Principles of appropriate antibiotic use for acute rhinosinusitis in
adults: background. Ann Intern Med.2001; 134(6):498
-505.
FREE FULL TEXT
10. Akkerman AE, van der Wouden JC, Kuyvenhoven MM, Dieleman JP,
Verheij TJM. Antibiotic prescribing for respiratory tract infections in Dutch
primary care in relation to patient age and clinical entities. J
Antimicrob Chemother.2004; 54(6):1116
-1121.
FREE FULL TEXT
11. Lindbaek M, Hjortdahl P. The clinical diagnosis of acute purulent
sinusitis in general practice: a review. Br J Gen
Pract.2002; 52(479):491
-495.
PUBMED
12. Williams JW Jr, Simel DL. Does this patient have sinusitis?
diagnosing acute sinusitis by history and examination.
JAMA.1993; 270(10):1242
-1246.
FREE FULL TEXT
13. Williamson I, Benge S, Moore M, Kumar S, Cross M, Little P. Acute
sinusitis: which factors do family physicians believe are most diagnostic and
best predict antibiotic efficacy? J Fam Pract.2006; 55(9):789
-796.
PUBMED
14. Osguthorpe JD, Hadley JA. Rhinosinusitis: current concepts in
evaluation and management. Med Clin North Am.1999; 83(1):27
-41.
PUBMED
15. McCormick AW, Whitney CG, Farley MM, et al. Geographic diversity
and temporal trends of antimicrobial resistance in Streptococcus
pneumoniae in the United States. Nat Med.2003; 9(4):424
-430.
PUBMED
16. Williams JW Jr, Aguilar C, Cornell J, et al. Antibiotics for acute
maxillary sinusitis. Cochrane Database Syst Rev.2003; (2):CD000243.17. Gwaltney JM Jr, Jones KG, Kennedy DW. Medical management of
sinusitis: educational goals and management guidelines. Ann Otol
Rhinol Laryngol Suppl.1995; 167:22
-30.
PUBMED
18. van Buchem FL, Knotterus JA, Schrijnemaekers VJ, Peeters MF.
Primary care based randomized placebo controlled trial of antibiotic treatment
in acute maxillary sinusitis. Lancet.1997; 349(9053):683
-687.
PUBMED
19. Lindbaek M, Hjortdahl P, Johnsen UL. Randomised double blind
placebo controlled trial of penicillin and amoxicillin in treatment of acute
sinus infections in adults. BMJ.1996; 313(7053):325
-329.
FREE FULL TEXT
20. Ah-See KW, Evans AS. Sinusitis and its management.
BMJ.2007; 334(7589):358
-361.
FREE FULL TEXT
21. Stalman W, van Essen GA, van der Graaf Y, de Melker RA. The end of
antibiotic treatment in adults with acute sinusitis-like complaints in general
practice? Br J Gen Pract.1997; 47(425):794
-799.
PUBMED
22. Merenstein D, Whittaker C, Chadwell T, Wegner B, D'Amico F. Are
antibiotics beneficial for patients with sinusitis complaints? a randomized
double-blind clinical trial. J Fam Pract.2005; 54(2):144
-151.
PUBMED
23. Bucher HC, Tschudi P, Young J, et al. Effect of
amoxicillin-clavulanate in clinically diagnosed acute rhinosinusitis: a
placebo controlled double blind randomized trial in general practice.
Arch Intern Med.2003; 163(15):1793
-1798.
FREE FULL TEXT
24. Varonen H, Kunnamo I, Savoleinen S, et al. Treatment of acute
rhinosinusitis diagnosed by clinical criteria or ultrasound in primary care: a
placebo controlled randomised trial. Scand J Prim Health
Care.2003; 21(2):121
-126.
PUBMED
25. De Sutter AI, De Meyere MJ, Christiaens TC, et al. Does amoxicillin
improve outcomes in patients with purulent rhinorrhea? J Fam
Pract.2002; 51(4):317
-323.
PUBMED
26. Hansen JG, Schmidt H, Grinstead P. Randomised double blind placebo
controlled trial of penicillin V in the treatment of acute maxillary sinusitis
in adults in general practice. Scand J Prim Health
Care.2000; 18(1):44
-47.
PUBMED
27. Nørrelund N. A controlled investigation of pivampicillin.
Ugeskr Laeger.1978; 140(45):2792
-2795.
PUBMED
28. Engels EA, Terrin N, Barza M, Lau J. Meta-analysis of diagnostic
tests for acute sinusitis. J Clin Epidemiol.2000; 53(8):852
-862.
PUBMED
29. Berg O, Carenfelt C. Analysis of symptoms and clinical signs in the
maxillary sinus empyema. Acta Otolaryngol.1988; 105(3-4):343
-349.
PUBMED
30. Low DE, Desrosiers M, McSherry J, et al. A practical guide for the
diagnosis and treatment of acute sinusitis. CMAJ.1997; 156(6)(suppl):S1
-S14.
31. Zalmanovici A, Yaphe J. Steroids for acute sinusitis.
Cochrane Database Syst Rev.2007; (2):CD005149.32. Meltzer EO, Bachert C, Staudinger H. Treating acute rhinosinusitis:
comparing efficacy and safety of mometasone furoate nasal spray, amoxicillin,
and placebo. J Allergy Clin Immunol.2005; 116(6):1289
-1295.
PUBMED
33. Dolor RJ, Witsell DL, Hellkamp AS, et al. Comparison of cefuroxime
with or without intranasal fluticasone for the treatment of rhinosinusitis:
the CAFFS trial: a randomized controlled trial. JAMA.2001; 286(24):3097
-3105.
FREE FULL TEXT
34. Nayak AS, Settipane GA, Pedinoff A, et al. Effective dose range of
mometasone furoate nasal spray in the treatment of acute rhinosinusitis.
Ann Allergy Asthma Immunol.2002; 89:271
-278.
PUBMED
35. Barlan IB, Erkan E, Bakir M, Berrak S, Basaran M. Intranasal
budesonide spray as an adjunct to oral antibiotic therapy for acute sinusitis
in children. Ann Allergy Asthma Immunol.1997; 78(6):598
-601.
PUBMED
36. Benninger MS, Sedory Holzer SE, Lau J. Diagnosis and treatment of
uncomplicated acute bacterial rhinosinusitis: summary of the Agency for Health
Care Policy and Research evidence-based report. Otolaryngol Head
Neck Surg.2000; 122(1):1
-7.
PUBMED
37. Peto R. Clinical trial methodology.
Biomedicine.1978; 28:24
-36.
PUBMED
38. Day SJ, Graham DF. Sample size and power for comparing two or more
treatment groups in clinical trials. BMJ.1989; 299(6700):663
-665.
FREE FULL TEXT
39. Little P, Williamson IG, Warner G, et al. Open randomised trial of
prescribing strategies in managing sore throat. BMJ.1997; 314(7082):722
-727.
FREE FULL TEXT
40. Little P, Gould C, Williamson I, Moore M, Warner G, Dunleavey J.
Pragmatic randomised controlled trial of two prescribing strategies for
childhood acute otitis media. BMJ.2001; 322(7282):336
-342.
FREE FULL TEXT
41. Little P, Rumsby K, Kelly J, et al. Information leaf-let and
antibiotic prescribing strategies for acute lower respiratory tract infection:
a randomized controlled trial. JAMA.2005; 293(24):3029
-3035.
FREE FULL TEXT
42. Hueston WJ, Eberlein C, Johnson D, Mainous A. Criteria used by
clinicians to differentiate sinusitis from viral upper respiratory tract
infection. J Fam Pract.1998; 46(6):487
-492.
PUBMED
43. Wilson S, Delaney B, Roalfe A, et al. Randomised controlled trials
in primary care: case study. BMJ.2000; 321(7252):24
-27.
FREE FULL TEXT
44. Fagan TJ. Nomogram for Bayes theorem. N Engl J
Med.1975; 293(5):257
.
PUBMED
45. de Ferranti SD, Ioannidis J, Lauu J, Anninger W, Barza M. Are
amoxicillin and folate inhibitors as effective as other antibiotics for acute
sinusitis? a meta-analysis. BMJ.1998; 317(7159):632
-637.
FREE FULL TEXT
46. de Bock GH, Dekker FW, Stolk J, Springer MP, Kievit J, Houwelingen
JC. Antimicrobial treatment in acute maxillary sinusitis: a meta-analysis.
J Clin Epidemiol.1997; 50(8):881
-890.
PUBMED
ARTICLE EN RAPPORT
La sinusite aiguë - traiter ou ne pas traiter?
Morten Lindbaek
JAMA. 2007;298:2543-2544.
Texte Complet
|