 |
 |

Emergence de virus de type Influenza B ayant une sensibilité réduite aux inhibiteurs de la neuraminidase
Shuji Hatakeyama, MD, PhD;
Norio Sugaya, MD;
Mutsumi Ito, DVM;
Masahiko Yamazaki, MD;
Masataka Ichikawa, MD;
Kazuhiro Kimura, MD, PhD;
Maki Kiso, DVM;
Hideaki Shimizu;
Chiharu Kawakami;
Kazuhiko Koike, MD, PhD;
Keiko Mitamura, MD;
Yoshihiro Kawaoka, DVM, PhD
RÉSUMÉ
 |  |
Contexte On sait peu de choses sur la fréquence de
génération et de transmissibilité des virus influenza B
ayant une sensibilité réduite aux inhibiteurs de la
neuraminidase. Par ailleurs, la transmission de virus résistants
influenza de type A ou B, n'a pas été reconnue à ce
jour.
Objectif Evaluer la prévalence et la transmissibilité
des virus de type B ayant une sensibilité réduite aux
inhibiteurs de la neuraminidase.
Schéma, environnement et patients Investigation de la
sensibilité des inhibiteurs de la neuraminidase d'isolats d'influenza B
chez 74 enfants et après traitement par oseltamivir et chez 348
patients non traités ayant une grippe (dont 66 adultes) examinés
dans 4 hôpitaux communautaires au Japon durant la saison grippale
2004-2005. Quatre-cent vingt deux virus de patients non traits et 74
échantillons de patients après traitement par oseltamivir ont
été analysés.
Principaux critères de jugement Un test d'inhibition à
la sialidase était utilisé pour évaluer les
sensibilités médicamenteuses des virus influenza B. Les
gènes neuraminidase and hémagglutinine des virus montrant une
sensibilité réduite aux inhibiteurs de la neuraminidase ont
été séquencés pour identifier les mutations
possédant le potentiel à conférer une réduction de
la sensibilité à ces médicaments.
Résultats Chez 1 enfant (1.4%) sur 74 ayant reçu
oseltamivir, nous avons mis en évidence un variant ayant une
réduction de la sensibilité au médicament
possédant une substitution sur la neuraminidase Gly402Ser. Nous avons
aussi mis en évidence des variants ayant une sensibilité
réduite porteur de mutations de type Asp198Asn, Ile222Thr, ou Ser250Gly
pour 7 virus (1.7%) sur 422 chez des patients non traités. Le revue des
informations cliniques et génétique virale disponibles chez ces
7 patients indiquaient que 4 avaient une probabilité d'avoir
été infectés au sein de la communauté alors que
les 3 restants avaient probablement été infectés par
contact avec des frères et soeurs libérant un virus mutant.
Conclusions Dans cette population, les virus influenza B ayant une
réduction de la sensibilité aux inhibiteurs de la neuraminidase
ne se rencontrent pas aussi fréquemment que les virus influenza A
résistants. Toutefois, ils semblent être transmis au sein de la
communauté et des familles, ce qui nécessite un suivi continu et
rapproché.
JAMA.
2007;297:1435-1442
L'utilisation clinique de tout antiviral peut entraîner le
développement de virus
résistants.1,2
Deux inhibiteurs de la neuraminidase, le zanamivir et l'oseltamivir, sont
efficaces contre la grippe et sont utilisés assez largement dans le
traitement de cette infection, en particulier au Japon.
3,4
Nous avons avec d'autres documenté l'émergence de virus de type
A résistants à l'oseltamivir, y compris les sous-types
H5N1,3,5-7
mais le même type d'informations sur les virus influenza de type B est
limité. Bien que les virus influenza de type B entraîne
généralement des épidémies plus faibles que les
virus de type A, ils sont néanmoins associés à des
épidémies annuelles et à des taux excessifs de
mortalité à travers le
monde.8
Parmi les deux types de virus B ayant une sensibilité réduite
qui ont fait l'objet de rapports, un était porteur d'une mutation
Arg152Lys (système de numération des acides aminés
adapté pour un N2
neuraminidase9;
la numération N2 est utilisée tout au long de cet article) dans
la neuraminidase et a été isolé d'un enfant
immuno-compromis traité par
zanamivir.10
L'autres virus avait une mutation Asp198As neuraminidase et a
été isolé d'un enfant immuno-compromis traité par
oseltamivir.11
Les substitutions connues de la neuraminidase identifiées dans les
virus résistants chez l'homme tendent à être
spécifiques de type ou de sous-type : Glu119Val, Arg292Lys, et
Asn294Ser pour la neuraminidase du sous-type N2; His274Tyr dans celle du
sous-type N1 (y compris non seulement les virus H1N1 mais aussi les virus
H5N1)6,7et Arg152Lys et Asp198Asn dans celle des virus de type
B.10,11 Toutes ses substitutions ont été
identifiées dans des résidus catalytiques ou structuraux dans
les sites actifs de la sialidase de la protéine neuraminidase,9 qui
sont relativement conservés dans toutes les molécules de
neuraminidase de type A et de type B et sont les cibles des inhibiteurs de la
neuraminidase.
|
|

|
|
Figure 1.. Distribution des participants
|
|
|
Les résultats des expériences sur culture cellulaire dans
lesquelles des passages multiples sont nécessaires pour la production
de virus résistants aux inhibiteurs de la
neuraminidase12
ont suggéré que la résistance à ces agents
survient rarement. Il est donc raisonnable qu'une fréquence faible de
résistance à l'oseltamivir—5,5% des enfants
âgés de 1 à 12 ans infectés par des virus de type A
et 0% des enfants infectés par des virus de type B—ait
été observée dans un essai
clinique.13
Des études plus récentes ont toutefois démontré un
taux plus élevé que ce qui était attendu de production de
virus influenza résistants de type A chez des enfants traités
par oseltamivir: 18% des enfants ayant une infection par un virus H3N2 5 et
16% ayant une infection par un virus de type H1N1
3
démontraient des variants résistants avec des mutations de la
neuraminidase après traitement médicamenteux.
Le fitness biologique des virus résistants aux inhibiteurs de la
neuraminidase diffèrent selon le type de mutations de la neuraminidase.
Dans les études chez la souris ou le furet, l'infectivité et la
transmissibilité des isolats cliniques des virus humains influenza A
portant une mutation Arg292Lys ou His274Tyr de leurs neuraminidases
étaient
compromises14-17;
un résultat similaire a été rapporté pour un virus
mutant de type B porteur d'une mutation Arg152Lys chez les
furets.10 En comparaison, un virus résistant avec une
mutation Glu119Val ayant infecté les furets, a été
transmis chez ces animaux aussi efficacement que le type sauvage du
virus.17 Le
virus influenza B porteur d'une substitution Asp198Asn croit de même que
le type sauvage du virus dans ce modèle
animal.18
Néanmoins, la pathogénicité et la transmissibilité
des virus résistants aux inhibiteurs de la neuraminidase demeurent des
questions en suspens porteuses d'une signification pour prédire des
souches pandémiques.
Au Japon, les inhibiteurs de la neuraminidase, le zanamivir et
l'oseltamivir ont été approuvés pour un usage clinique
respectivement en 2000 et 2001 et sont maintenant utilisés plus
intensivement que partout ailleurs dans le
monde.3,4
Au cours ded l'hiver 2004-2005, un virus influenza B entraînait une
épidémie à large échelle au Japon, créant
des opportunités pour évaluer dans un contexte naturel la
prévalence et la transmission des virus influenza de type B ayant une
sensibilité réduite aux inhibiteurs de la neuraminidase. Les
résultats rapportés ici suggèrent un taux faible mais
notable d'émergence de virus de type B ayant une sensibilité
réduite aux inhibiteurs de la neuraminidase et leur transmission de
personne à personne, à la fois dans la communauté et au
sein de simples familles.
METHODES
Population de l'étude et contextes Des prélèvements
pharyngé et nasal pour analyse à la recherche de virus influenza
de type B ont été pratiqués chez des patients qui
consultaient dans le service de pédiatrie de 4 hôpitaux
généraux du Japon durant la période grippale de
2004-2005. Afin d'identifier la fréquence de développement des
virus influenza de type B résistants à la neuraminidase
après traitement par oseltamivir, nous avons analysé les
échantillons appariés de chaque patient, l'un
prélevé lors de la consultation initiale à
l'hôpital (échantillon avant traitement) et l'autre au cours du
traitement par oseltamivir (échantillon après traitement). Les
patients diagnostiqués comme ayant une infection par virus influenza de
type B par un kit de diagnostic rapide qui recevaient un traitement par
oseltamivir, et desquels pouvaient être recueillis au moins deux
échantillons en séquence pour isoler le virus, étaient
inclus dans la première série d'études
(FIGURE 1). Dans la
deuxième série, nous avons essayé d'évaluer dans
un contexte civil la prévalence des virus influenza de type B ayant une
sensibilité réduite aux inhibiteurs de la neuraminidase. A ces
fins, nous avons obtenu des échantillons avant le traitement par
oseltamivir à partir des patients qui consultaient dans les 4
hôpitaux généraux. Le virus influenza de type B
isolé dans ces échantillons et les virus des échantillons
avant traitement de la première série d'études ont
été combinés et analysés
(Figure 1). Ces études
incluant des patients consultant dans des hôpitaux
généraux, plusieurs membres des familles ont consulté au
même endroit. Un consentement oral a été obtenu des
parents de tous les patients. Cette étude a été
menée après approbation des comités d'éthique de 3
des 4 hôpitaux; dans le cas du seul hôpital sans comité
d'éthique, les activités liées à l'étude
ont été menées sous les auspices du consentement
informé.
Echantillons cliniques et virus
Les prélèvements pharyngé et nasal destinés
à isoler le virus influenza de type B étaient recueillis par le
médecin traitant après obtention du consentement informé.
Les virus isolés étaient stockés à-80°C
jusqu'à leur utilisation. Les isolats du virus étaient
utilisés comme population mixte sans purification de la plaque. Des
cellules rénales canine Madin-Darby surexprimant le gène
β-galactoside  2,6-sialyltransférase I (ST6Gal I) 19
étaient utilisées pour isoler le virus et pour le test sur
plaque. Ces cellules permettent la croissance d'isolats cliniques de virus
influenza humain mieux que les cellules rénales canines Madin-Darby non
manipulées.19
Pour évaluer la sensibilité des virus influenza B aux
inhibiteurs de la neuraminidase, la concentration d'inhibiteur de
neuraminidase nécessaire pour inhiber 50% de l'activité de la
sialidase des virus (IC50) était déterminée avec des
isolats de virus B avant et après traitement à l'aide d'un test
d'inhibition de la
sialidase.19,20
Les valeurs IC50 montrées dans cette étude ont été
évaluées pour des virus présents dans des liquides
supernatants de culture, sans purification de la plaque des isolats. Pour les
souches démontrant une diminution de la sensibilité aux
inhibiteurs, nous avons séquencé les gènes de la
neuraminidase et de l'hémagglutinine. 2,6-sialyltransférase I (ST6Gal I) 19
étaient utilisées pour isoler le virus et pour le test sur
plaque. Ces cellules permettent la croissance d'isolats cliniques de virus
influenza humain mieux que les cellules rénales canines Madin-Darby non
manipulées.19
Pour évaluer la sensibilité des virus influenza B aux
inhibiteurs de la neuraminidase, la concentration d'inhibiteur de
neuraminidase nécessaire pour inhiber 50% de l'activité de la
sialidase des virus (IC50) était déterminée avec des
isolats de virus B avant et après traitement à l'aide d'un test
d'inhibition de la
sialidase.19,20
Les valeurs IC50 montrées dans cette étude ont été
évaluées pour des virus présents dans des liquides
supernatants de culture, sans purification de la plaque des isolats. Pour les
souches démontrant une diminution de la sensibilité aux
inhibiteurs, nous avons séquencé les gènes de la
neuraminidase et de l'hémagglutinine.
Sensibilité de la sialidase aux inhibiteurs de la neuraminidase
Les sensibilités de la sialidase des virus influenza de type B aux
inhibiteurs de la neuraminidase étaient évaluées par un
test d'inhibition de la sialidase décrit
précédemment.19,20
En bref, l'acide
2'-(4-méthylumbelliféryl)- ;-D-N-acétylneuraminique
(MUNANA; Sigma, St Louis, Mo) à la concentration finale de 0.1 mmol/l
était utilisé comme substrat. ;-D-N-acétylneuraminique
(MUNANA; Sigma, St Louis, Mo) à la concentration finale de 0.1 mmol/l
était utilisé comme substrat.
Dix microlitres de dilution virale (prédéfinie pour contenir
une activité sialidase dans une zone de 800-1200 unités de
fluorescence dans ce test) et 10 µl d'un inhibiteur de la neuraminidase
(0.01 nmol/l à 10 µmol/l) dans une solution tampon calcium-MES (33
mmol/l 2-[N-morpholino] acide éthanesulfonique, 4 mmol/l CaCl2, pH 6.0)
étaient mélangés et incubés à 37°C
pendant 30 minutes, suivis par l'addition de 30 µl du substrat. Les
mélanges étaient ensuite incubés à 37°C
pendant 60 minutes, et la réaction était stoppée en
ajoutant 150 µl de 0.1 mol/l d'hydroxide de sodium dans 80%
d'éthanol (pH 10.0). Nous avons quantifié la fluorescence
à une longueur d'onde de 360 nm permettant une stimulation et une
émission de longueur d'onde de 465 nm. La valeur IC50 était
déterminée par extrapolation de la relation entre la
concentration de l'inhibiteur et le pourcentage d'inhibition de fluorescence.
Les résultats sont rapportés sous la forme de moyenne des
valeurs dupliquées de l'IC50. Le carboxylate d'oseltamivir (GS4071;
Roche Products, Bâle, Suisse), le métabolite actif de la
prodrogue éthyl ester phosphate d'oseltamivir, et le zanamivir
(Relenza; GlaxoSmithKline, Brentford, UK) ont été
utilisés comme inhibiteurs de la neuraminidase.
Analyse séquentielle des gènes de la neuraminidase et de l'hémagglutinine
L'ARN viral a été extrait du virus dans le liquide
supernatant des cultures cellulaires grâce à un kit d'extraction
de l'ARN (ISOGEN-LS; Nippon Gene, Tokyo, Japon), sans purification
préalable de la plaque du virus. Une transcription inverse a
été réalisée par transcriptase inverse
(SUPERSCRIPT III; Invitrogen, Carlsbad, Californie) et un primer
complémentaire (ou stimulus) à la fin 3' de l'ARN viral (5'-A G
C A G A A G C A G A G C A-3'). Des produits ADNc ont été
utilisés pour amplifier les gènes de la neuraminidase et de
l'hémagglutinine par une méthode de réaction en
chaîne par la polymérase (Pfu Ultra DNA Polymerase; Stratagene,
La Jolla, Calif) (primer des séquences et conditions d'amplification
disponibles auprès des auteurs sur demande). Nous avons cloné
ces produits dans un vecteur pCRBlunt II-TOPO (Invitrogen) et les avons
transformés en cellules chimiquement compétentes TOP10
(Invitrogen). Les cellules transformées ont poussé dans un
milieu Luria broth agar contenant 50 mg/l de kanamycine, après lequel
les colonies résistantes à la kanamycine ont été
sélectionnées et incubées dans un milieu de Luria
à 37°C toute une nuit dans un incubateur mis en mouvement continu.
L'ADN plasmide a été extrait par un système
MagExtractor-plasmid (TOYOBO, Osaka, Japon). Nous avons determiné les
séquences complètes des gènes de la neuraminidase et de
l'hémagglutinine par un séquençage cyclique grâce
à une chimie de fin de séquençage par colorant (Big Dye;
Applied Biosystems, Foster City, Californie) sur les auto-séquenceurs
Applied Biosystems 3100 ou 3130Xl utilisant M13F-20, primers
spécifiques de la neuraminidase ou de l'hémagglutinine. Pour
chaque échantillon, 5 à 8 clones d'ADNc des gènes de la
neuraminidase et de l'hémagglutinine ont été
analysés.
RESULTATS
Population de l'étude
Au total, 75 paires d'échantillons avant et après traitement
ont été recueillies auprès des patients
pédiatriques. Une paire a été exclue car le virus
influenza n'avait été isolé ni de l'échantillon
pré-traitement ni de l'échantillon post-traitement. En
conséquence, 74 patients âgés de 0 à 15 ans
(médiane, 3 ans) ayant une infection par virus influenza B ont
été inclus dans l'étude
(Figure 1). Tous les patients
étaient traités par oseltamivir pendant 5 jours. Dix-huit
enfants ont reçu 2 mg/kg de poids corporel deux fois par jour, tandis
que les autres 56 enfants recevaient des doses unitaires basées sur le
poids 21(poids corporel 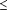 15 kg, 30 mg deux fois par jour; > 15-23 kg,
45 mg deux fois par jour; > 23-40 kg, 60 mg deux fois par jour et > 40
kg, 75 mg deux fois par jour). 15 kg, 30 mg deux fois par jour; > 15-23 kg,
45 mg deux fois par jour; > 23-40 kg, 60 mg deux fois par jour et > 40
kg, 75 mg deux fois par jour).
Dans la deuxième série d'expérimentation, nous avons
analysé au total 442 virus influenza B isolés de patients avant
le traitement (348 patients plus les 74 patients mentionnés ci-dessus)
au cours de la saison grippale 2004-2005
(Figure 1). Parmi les 422
patients, 356 étaient des enfants, âgés de 0 à 15
ans (médiane, 5 ans); les 66 autres patients étaient des adultes
de 16 ans ou plus (extrêmes, 17 à 61 ans; médiane, 34
ans).
Emergence de virus influenza B ayant une sensibilité réduite aux inhibiteurs de la neuraminidase
Après traitement par oseltamivir, les virus ont été
récupérés de tous les échantillons
pré-traitement et de 65 échantillons post-traitement recueillis
chez 74 enfants ayant reçu un traitement complet d'oseltamivir. Chez un
enfant, (1.4%), la valeur IC50 de l'isolat testé après
traitement contre zanamivir et oseltamivir avait été
multiplié respectivement par 7.1 et 3.9, par rapport au virus
isolé avant traitement
(TABLE, patient 1). Cet enfant
était un garçon de 7 ans, immunocompétent, ayant
reçu de l'olsetamivir immédiatement après le diagnostic.
Un virus ayant une sensibilité réduite aux inhibiteurs de la
neuraminidase a été isolé d'un prélèvement
pharyngé recueilli le 3ème jour après instauration du
traitement par oseltamivir. Pour comprendre la base moléculaire de la
réduction de la sensibilité observée aux
médicaments, nous avons cloné le gène de la neuraminidase
à partir du virus ayant cette propriété. L'analyse
séquentielle a révélé une substitution d'acide
amine Gly402Ser, dans 7 des 8 clones d'ADNc du gène de la
neuraminidase. Aucune autre différence n'a été
observée dans la séquence d'acides aminés des
protéines de la neuraminidase et de l'hémagglutinine entre le
parent de type sauvage et le virus mutant après traitement. La mutation
de la neuraminidase Gly402Ser était située près du centre
de l'enzyme sialidase.
|
|

|
|
Tableau.. Isolats influenza B ayant une sensibilité réduite aux
inhibiteurs de la neuraminidase avant et après traitement antiviral
|
|
|
Virus influenza B ayant une diminution de la sensibilité aux inhibiteurs de la neuraminidase détectés chez des patients avant traitement
Les valeurs IC50 (extrêmes interquartiles) des virus influenza B
isolés chez 422 patients non traités au cours de la saison
grippale 2004-2005 et testés à la fois contre l'oseltamivir et
le zanamivir avec un test d'inhibition de la sialidase ont été
respectivement de 70.5 (55.8-85.1) nmol/l et 10.1 (7.0-15.8) nmol/l
(FIGURE 2). Considérant
le niveau d'augmentation de la valeur IC50 du virus à partir de
l'échantillon après traitement par rapport à celle de la
valeur du virus original recueilli avant le traitement par oseltamivir du
patient 1, nous avons considéré les virus dont les valeurs IC50
étaient plus élevées de 1,5 fois par rapport à
l'extrême interquartile supérieur au troisième quartile
comme étant résistants au traitement
(Figure 2). A l'aide de ce
critère, 7 (1.7%) des 422 virus influenza B isolés de patients
non traités (Tableau,
patients 2-8) ont été trouvés comme ayant une
sensibilité réduite au zanamivir, oseltamivir, ou aux deux.
Chacun des 7 isolats ayant une sensibilité réduite contenait des
substitutions d'acides aminés dans la neuraminidase au centre actif de
la sialidase, en comparaison avec la séquence consensus de la
neuraminidase de type B: 3 avaient des mutations Asp198Asn, trois avaient des
mutations Ile222Thr, et un avait une mutation Ser250Gly
(Tableau). Aucun de ces
patients n'avait une affection sousjacente et aucun n'avait reçu de
traitement immunosuppresseur.
|
|

|
|
Figure 2.. Distribution des valeurs IC50 des virus Influenza B isolés chez 422
patients avant traitement, évalués contre carboxylate
d'oseltamivir et zanamivir
|
|
|
Un garçon âgé de 8 ans a été
diagnostiqué comme ayant une infection à virus influenza B 6
jours avant le début d'une grippe de type B chez sa soeur d'un an
(patient 3). Les valeurs IC50 pour l'isolat avant traitement du patient 2
(47.4 nmol/l pour le zanamivir et 237.3 nmol/L pour l'oseltamivir) indiquaient
une diminution de la sensibilité des isolats à ces
composés. Nous avons identifié une mutation neuraminidase en
position 198 (Asp198Asn) dans tous les 8 clones ADNc du gène de la
neuraminidase de cet isolat. Le virus isolé du patient 3 montrait aussi
une diminution de la sensibilité au zanamivir et à l'oseltamivir
(Tableau).
Les analyses séquentielles des gènes de la neuraminidase et
de l'hémagglutinine étaient identiques entre les virus
isolés des patients 2 et 3, y compris par la présence d'une
mutation Asp198Asn dans la protéine neuraminidase (dans tous les 8
clones ADNc du gène neuraminidase des isolats du patient 3). En
conséquence, il est possible que le patient 2 ait été
infecté par un virus influenza de type B ayant une sensibilité
réduite aux inhibiteurs de la neuraminidase et ait transmis ce virus
à sa sœur, le patient 3.
Un autre virus influenza B possédant une mutation Asp198Asn de la
neuraminidase a été isolé du patient 4 (âgée
de 6 ans, sexe féminin) le 9 février 2005, avant le traitement
par oseltamivir (Tableau).
Cette mutation de la neuraminidase a été observée dans
les 7 clones de l'ADNc de cet isolat. Sa sœur de 4 ans, chez laquelle un
virus influenza de type B avait été isolé le 31 janvier
2005, avait reçu de l'oseltamivir entre le 31 janvier et le 4
février (Tableau). Ces
séquences de gènes à la fois de la neuraminidase et de
l'hémagglutinine des deux patients étaient identiques, à
l'exception d'une substitution d'un acide aminé de la neuraminidase en
position 198. En conséquence, il est possible qu'un virus
résistant au traitement ait pu surgir chez la sœur de 4 ans au
cours du traitement par oseltamivir et ait été transmis au
patient 4. Toutefois, ayant été incapables d'obtenir des
échantillons après le traitement par oseltamivir chez cette
enfant de 4 ans, nous ne pouvons prouver que ceci a été le
cas.
Les valeurs IC50 des mutants Asp198Asn allaient de 42 à 62 nmol/l
(zanamivir) et de 204 à 255 nmol/l (oseltamivir), indiquant que la
mutation était associée à des réductions
respectives de la sensibilité de 3 à 4 fois et de 4 à 6
fois par rapport aux valeurs médianes correspondantes IC50 pour le
groupe entier des virus de type B. Le variant ayant une sensibilité
réduite à l'oseltamivir avec une mutation Asp198Asn
récemment identifiée par Gubareva11 et par Mishin et al18 dans
une échantillon après traitement chez un enfant immuno-compromis
ayant un virus influenza de type B. Ceci est en faveur de la notion que cette
mutation a été introduite au cours du traitement par oseltamivir
et qu'elle diminue la sensibilité aux inhibiteurs à la
neuraminidase.
Plusieurs virus de type B porteurs des mutations de la neuraminidase ayant
une diminution de la sensibilité ont également été
identifiée chez d'autres patients. Des virus porteurs de la mutation
Ile222Thr ont été isolés sur des échantillons
avant traitement chez trois 3 patients: patients 5 et 6 (fratrie) et patient 7
(Tableau). Les séquences
nucléotidiques des gènes de la neuraminidase et de
l'hémagglutinine des isolats de ces patients étaient identiques,
et une mutation de la neuraminidase Ile222Thr a été
observée chez tous les clones d'ADNc de chaque gène viral NA.
Les valeurs IC50 des virus porteurs de la mutation Ile222Thr allaient de 443
à 514 nmol/l (oseltamivir), ce qui représente une diminution de
la sensibilité de six à sept fois par rapport aux valeurs
médianes IC50 pour les virus de type B
(Tableau). Cette mutation
semblait ne pas avoir d'effet majeur sur la sensibilité virale au
zanamivir. Un virus influenza B ayant une sensibilité réduite
aux inhibiteurs de la neuraminidase a également été
isolé du patient 8, une femme de 22 ans
(Tableau). L'isolat du patient
8 possédait une mutation Ser250Gly pour les 7 clones ADNc du
gène de la neuraminidase. La mutation Ser250Gly conférait une
résistance multipliée par environ 19 fois au zanamivir (par
rapport à la valeur médiane IC50 du virus de type B), mais ne
diminuait pas la sensibilité à l'oseltamivir.
Aucun des membres de la famille des patients 2, 5, 7, et 8 n'a
été affecté par le virus influenza B avant le
début des symptômes, suggérant qu'ils aient pu
infectés par des mutants ayant une diminution de la sensibilité
et circulant au sein de la communauté. Ces résultats
suggèrent que les virus influenza B ayant une diminution de la
sensibilité aux inhibiteurs de neuraminidase pourraient être
transmis de personne à personne, non seulement au sein des mêmes
familles mais aussi parmi les membres d'une même communauté.
|
|

|
|
Figure 3.. Localisations des mutations sur la structure en 3D de la neuraminidase
|
|
|
Enfin, nous n'avons pas observé de différence
appréciable dans l'évolution clinique de l'infection virale
entre les patients infectés par le type sauvage des virus ou ceux ayant
une diminution de la sensibilité aux inhibiteurs à la
neuraminidase. Les durées moyennes de la fièvre après
traitement antiviral ont été respectivement de 2.4, 2.6, et 2.0
jours chez les infectés par les virus de type sauvage (n=32), chez ceux
ayant une sensibilité réduite aux inhibiteurs de la
neuraminidase (patient 2 [3 jours], patient 3 [5.5 jours], patient 7 [1 jour],
patient 8 [1 jour]), et patient ayant le variant s'étant
développé au cours du traitement (patient 1). De même,
nous n'avons pas trouvé de différence appréciable
concernant l'importance de la diffusion du virus (durée et titre),
entre les patients infectés par un virus résistant au traitement
et ceux infectés par un virus sensible au traitement. Toutefois, le
nombre de patients infectés par des virus ayant une sensibilité
réduite au traitement est trop faible pour évaluer la
signification statistique de l'effet de la résistance au traitement sur
la diffusion du virus.
COMMENTAIRES
Nous avons démontré que les virus influenza B ayant une
sensibilité réduite aux inhibiteurs de la neuraminidase peuvent
émerger au cours de traitements systématiques et que ces mutants
semblent être transmis de personne à personne, non seulement au
sein d'une même famille, mais peut-être aussi par contacts au sein
de la communauté. Le taux de production du virus influenza de type B
ayant une sensibilité réduite au cours d'un traitement par
oseltamivir dans cette étude, 1.4%, est plus faible que celui des virus
influenza de type A (5.5%-18%).3,5,13 Cette différence pourrait
refléter les doses plus élevées d'oseltamivir
utilisées dans notre étude (76% des patients ayant reçu
des doses thérapeutiques par rapport à leur poids, en contraste
à la dose biquotidienne de 2 mg/kg administrée
uniformément dans les études japonaises
précédentes3,5).
Quatre mutations de la neuraminidase de type B diminuent la
sensibilité aux inhibiteurs de la neuraminidase : substitutions
Asp198Asn, Ile222Thr, Ser250Gly, et Gly402Ser. Les résidus 198, 222, et
250 sont situés dans la structure du site actif de la neuraminidase,
qui interagit avec les résidus catalytiques des liens hydrogènes
ou des ponts salins (FIGURE
3).9,22
Les résidus structuraux Asp198 et Ser 250 (le résidu
correspondant de la neuraminidase de type A est Ala) interagissent avec les
résidus catalytiques Arg152 et Arg224, respectivement, et Ile222 forme
une poche hydrophobique dans laquelle vient s'insérer le
substrat.22
La nouvelle substitution détectée dans la neuraminidase d'un
virus retrouvé chez un patient traité par oseltamivir dans cette
étude est survenue au niveau du résidu 402. Bien que Gly402 ne
soit pas un résidu catalytique ou structural, il est situé
près du centre enzymatique de la sialidase
(Figure 3). En
conséquence, la substitution Gly402Ser peut modifier l'interaction du
centre enzymatique et des inhibiteurs de la neuraminidase, entraînant
une diminution de la sensibilité au traitement. D'autres analyses sont
nécessaires pour comprendre l'interaction de ce résidu avec
l'acide sialique.
Les mutations structurales que nous avons mises en évidence semblent
diminuer la sensibilité à l'oseltamivir de façon
modérée par rapport à la mutation catalytique Arg292Lys.
En les testant contre l'oseltamivir, les valeurs IC50 des virus H3N2 porteurs
d'une mutation structurale Glu119Val ou Asn294Ser étaient
respectivement de 239 nmol/l ou 106 nmol/l,5 tandis que celle pour la souche
H5N1 ayant une mutation structurale His274Tyr était de 763
nmol/L.6 D'un
autre côté, la mutation catalytique Arg292Lys des virus N2
conférait un niveau élevé de résistance à
l'oseltamivir (IC50 >10 000
nmol/l).5 Les
virus ayant des mutations structurales peuvent avoir une capacité de
transmission chez les animaux sous expérimentation, comme il a
été démontré pour un variant de type A ayant une
mutation structurale en position 119 ou
274.17 Ces
résultats suggèrent que les virus influenza ayant une mutation
structurale de la neuraminidase peuvent constituer un problème
clinique, même si leurs valeurs IC50 sont plus faibles que celles des
virus ayant des mutations du domaine catalytique. En conséquence, les
rapports récents sur la résistance à l'oseltamivir des
virus influenza A H5N1 ayant une mutation structurale His274Tyr
6,7
nécessite une attention particulière et un suivi soigneux de
l'extension des variants résistants.
La question reste de savoir si les variants isolés des patients non
traits démontrent une transmissibilité de personne à
personne dans la communauté ou l'émergence spontanée de
mutants ayant une sensibilité réduite au traitement. Nous
pensons plutôt à la première possibilité car le
<< réseau global de sensibilité aux inhibiteurs de la
neuraminidase >> n'a pas mis en évidence de virus influenza
présentant une résistance aux inhibiteurs de la neuraminidase
avant que ces traitements ne soient introduits en
clinique.23,24
Toutefois, au cours des trois premières saisons grippales (1999-2002)
suivant l'introduction des inhibiteurs de la neuraminidase sur le
marché, le réseau a détecté un faible nombre (8
[0.35%] sur 2287 isolats) de virus influenza, isolés chez des patients
non traités, ayant une sensibilité diminuée aux
inhibiteurs de la
neuraminidase.25
Parmi ceux-ci, 2 possédaient des mutations de la neuraminidase avant
d'être identifiés dans des virus résistants aux
inhibiteurs de la neuraminidase. Par ailleurs, au cours de la saison grippale
2003-2004, le réseau a mis en évidence 3 virus H3N2 parmi 1180
échantillons recueillis au Japon qui contenaient des mutations de la
neuraminidase conférant une résistance aux inhibiteurs de la
neuraminidase, bien qu'il ne soit pas possible de déterminer avec
certitude si ces patients avaient été exposés aux
inhibiteurs de la neuraminidase ou s'il s'agissait d'individus traités
par inhibiteur de la
neuraminidase.26
Nos observations sont compatibles avec celles des données de
surveillance, qui impliquent une transmission possible de virus
résistants aux inhibiteurs de la neuraminidase de personne à
personne.
Lorsque des enfants sains reçoivent de l'oseltamivir à raison
de 2 mg/kg de poids corporel, le pic moyen de concentration plasmatique du
carboxylate d'oseltamivir, le métabolite actif du médicament,
est de 630 nmol/l chez les enfants âgés de 3 à 5 ans et de
426 nmol/l chez les enfants âgés de 2
ans.27 Ceci
indique que les valeurs IC50 pour les virus influenza B testés contre
l'oseltamivir dans notre étude étaient proches de la
concentration plasmatique, suggérant que ce traitement peut ne pas
être aussi efficace contre le virus influenza B que contre le virus
influenza A. En comparaison, la concentration locale de zanamivir dans le
tractus humain respiratoire est estimé être plus de 10 000 nmol/l
lorsque les adultes sains inhalant 10 mg de zanamivir, 28 bien au-dessus des
valeurs IC50 du virus influenza B.
Au Japon, les prescriptions d'oseltamivir ont été
estimées être 90 fois plus fréquentes que celles du
zanamivir au cours de la saison grippale 2004-2005 (note officielle du
Ministère de la Santé, du Travail et des Affaires Sociales du
Japon). Il est donc possible que les mutants ayant une sensibilité
réduite au traitement observes dans les communautés de cette
étude aient été générés par la large
utilisation de l'oseltamivir. Une surveillance continue de l'émergence
ou de la diffusion de virus influenza résistants aux inhibiteurs de la
neuraminidase est d'une importance majeure.
Enfin, l'évolution clinique de l'infection due au virus influenza de
type B dans cette étude ne semble pas être affectée par la
sensibilité du virus aux inhibiteurs de la neuraminidase, bien qu'il
soit nécessaire d'étudier de grands nombres de cas pour
confirmer cette impression. Néanmoins, les symptômes des patients
infectés par les virus ayant des sensibilités réduites
aux inhibiteurs de la neuraminidase ont été similaires à
ceux des patients infectés par le type sauvage du virus, ce qui montre
que ces virus mutants, au moins ceux porteurs d'une mutation structurale, ne
perdent pas de virulence, même s'ils ont évolué vers un
statut qui est moins sensible au traitement. D'autres études des
propriétés biologiques des virus influenza résistants aux
inhibiteurs de la neuraminidase sont nécessaires pour pleinement
évaluer leur pathogénicité chez l'homme.
Informations sur les auteurs
Correspondance: Yoshihiro Kawaoka, DVM, PhD, Division of Virology,
Department of Microbiology and Immunology, Institute of Medical Science,
University of Tokyo, 4-6-1 Shirokanedai, Minato-ku, Tokyo 108-8639,
Japan
(kawaoka{at}ims.u-tokyo.ac.jp).
Contributions des auteurs: Les Drs Hatakeyama et Kawaoka ont eu un
accès complet à toutes les données de l'étude et
acceptent la responsabilité de l'intégrité des
données et de l'exactitude de l'analyse des données.
Conception et schema de l'étude: Hatakeyama, Sugaya,
Kawaoka.
Recueil des données: Hatakeyama, Ito, Yamazaki, Ichikawa,
Kimura, Kiso, Shimizu, Kawakami,Mitamura.
Analyse et interprétation des données: Hatakeyama, Koike,
Kawaoka.
Revue critique du manuscrit: Sugaya, Ito, Yamazaki, Ichikawa,
Kimura, Kiso, Shimizu, Kawakami, Koike, Mitamura, Kawaoka.
Analyse statistique: Hatakeyama.
Obtention du financement: Kawaoka.
Aide administrative, technique et matérielle: Sugaya.
Supervision de l'étude: Kawaoka.
Liens financiers: Le Dr Kawaoka déclare avoir reçu des
honoraires d'orateur de Chugai Pharmaceuticals, Novartis, Sankyo, Toyama
Chemical, et Wyeth, et une bourse de Chugai Pharmaceuticals, Daiichi
Pharmaceutical, Sankyo, et Toyama Chemical. Le Dr Sugaya déclare avoir
reçu des honoraires d'orateur de Chugai Pharmaceuticals, Sankyo
Pharmaceuticals, et Takeda. Le Dr Koike déclare avoir reçu une
bourse de Chugai Pharmaceuticals. Les informations rapportées dans
cette étude ont été incluses dans une demande de licence
pour de nouvelles substitutions d'acides aminés à l'origine
d'une modification de la sensibilité aux inhibiteurs de la
neuraminidase, compositions contenant ces substitutions, et méthodes
pour les détecter. Aucun autre lien financier n'a été
déclaré.
Financement/Soutien: ce travail a bénéficié du
soutien sous la forme de bourses de Core Research for Evolutional Science and
Technology (CREST), Japon; de bourses de la Japan Science and Technology
Agency (JST); e bourses du Ministère de l'Education, Culture, Sports,
Science et Technologie et du Ministère de la Santé, du Travail
et des Affaires Sociales du Japon; et de bourses du National Institute of
Allergy and Infectious Diseases, National Institutes of Health. Le carboxylate
d'oseltamivir utilise dans cette étude était fourni par Produits
Roche.
Rôle des sponsors: Aucune des sources de financement n'a
joué de rôle dans le schéma ou la conduite de
l'étude, le recueil, le contrôle, la gestion, l'analyse ou
l'interprétation des données, ni dans la préparation, la
revue ou l'approbationdu manuscrit.
Remerciements: Nous remercions le biostatisticien Hiroshi Ohtsu, MS
(Department of Clinical Bioinformatics, University of Tokyo), pour ses
conseils sur les analyses statistiques. Nous remercions Larisa Gubareva, PhD
(Department of Internal Medicine, University of Virginia Health Sciences
Center), pour nous avoir indiqué un protocole pour le test d'inhibition
de la sialidase, John Gilbert, BS (travailleur indépendant), pour avoir
publié le manuscrit, et Krisna Wells, BS, RN (University of
Wisconsin-Madison), pour son assistance technique. Nous remercions aussi Hideo
Cho, MD (Department of Pediatrics, Kawasaki Municipal Hospital, Kanagawa,
Japan), pour sa supervision. Aucune des personnes remerciées n'a
reçu de compensation à l'exception de John Gilbert, qui avait un
contrat et a reçu un salaire mensuel du Dr Kawaoka afin de fournir ses
services éditoriaux.
Affiliations des auteurs: Division of Virology, Department of
Microbiology and Immunology, Institute of Medical Science (Drs Hatakeyama,
Ito, Kiso, et Kawaoka), Department of Infectious Diseases, Graduate School of
Medicine (Drs Hatakeyama et Koike), and International Research Center for
Infectious Diseases, Institute of Medical Science (Dr Kawaoka), University of
Tokyo, Tokyo, Japan; Department of Pediatrics, Keiyu Hospital, Kanagawa, Japan
(Dr Sugaya); Core Research for Evolutional Science and Technology (CREST),
Japan Science and Technology Agency, Saitama (Drs Ito, Kiso, et Kawaoka); Zama
Children's Clinic, Kanagawa (Dr Yamazaki); Department of Pediatrics, Isehara
Kyodo Hospital, Kanagawa (Drs Ichikawa and Kimura); Kawasaki City Institute of
Public Health, Kanagawa (Mr Shimizu); Yokohama City Institute of Health,
Kanagawa (Ms Kawakami); Department of Pediatrics, Eiju General Hospital, Tokyo
(Dr Mitamura); Department of Pathobiological Sciences, School of Veterinary
Medicine, University of Wisconsin-Madison (Dr Kawaoka).
BIBLIOGRAPHIE
 |  |
1. Pillay D, Zambon M. Antiviral drug resistance.
BMJ. 1998;317:660
-662.
FREE FULL TEXT
2. De Clercq E. Antiviral drugs in current clinical use. J
Clin Virol. 2004;30:115
-133.
PUBMED
3. Ward P, Small I, Smith J, Suter P, Dutkowski R. Oseltamivir
(Tamiflu) and its potential for use in the event of an influenza pandemic.
J Antimicrob Chemother.2005; 55(suppl 1):i5
-i21.
FREE FULL TEXT
4. Roche. Factsheet Tamiflu. December 2005.
http://www.roche.com/med_mbtamiflu05e.pdf.
Accessed July 1, 2006.5. Kiso M, Mitamura K, Sakai-Tagawa Y, et al. Resistant influenza A
viruses in children treated with oseltamivir: descriptive study.
Lancet. 2004;364:759
-765.
PUBMED
6. Le QM, Kiso M, Someya K, et al. Avian flu: isolation of
drug-resistant H5N1 virus [published correction appears in
Nature. 2005;438:754
].
PUBMED
Nature. 2005;437
: 1108.
PUBMED
7. de Jong MD, Tran TT, Truong HK, et al. Oseltamivir resistance
during treatment of influenza A (H5N1) infection. N Engl J
Med. 2005;353:2667
-2672.
PUBMED
8. Treanor JJ. Influenza virus. In: Mandell GL, Bennett JE,
Dolin R, eds. Principles and Practice of Infectious Diseases.
6th ed. Philadelphia, Pa: Elsevier/Churchill Livingstone; 2005:2060
-2085.9. Colman PM, Hoyne PA, Lawrence MC. Sequence and structure alignment
of paramyxo-virus hemagglutinin-neuraminidase with influenza virus
neuraminidase. J Virol.1993; 67:2972
-2980.
FREE FULL TEXT
10. Gubareva LV, Matrosovich MN, Brenner MK, Bethell RC, Webster RG.
Evidence for zanamivir resistance in an immunocompromised child infected with
influenza B virus. J Infect Dis.1998; 178:1257
-1262.
FREE FULL TEXT
11. Gubareva LV. Molecular mechanisms of influenza virus resistance to
neuraminidase inhibitors. Virus Res.2004; 103:199
-203.
PUBMED
12. McKimm-Breschkin JL. Resistance of influenza viruses to
neuraminidase inhibitors—a review. Antiviral
Res. 2000;47:1
-17.
PUBMED
13. Whitley RJ, Hayden FG, Reisinger KS, et al. Oral oseltamivir
treatment of influenza in children. Pediatr Infect Dis
J. 2001;20:127
-133.
PUBMED
14. Carr J, Ives J, Kelly L, et al. Influenza virus carrying
neuraminidase with reduced sensitivity to oseltamivir carboxylate has altered
properties in vitro and is compromised for infectivity and replicative ability
in vivo. Antiviral Res.2002; 54:79
-88.
PUBMED
15. Herlocher ML, Carr J, Ives J, et al. Influenza virus carrying an
R292K mutation in the neuraminidase gene is not transmitted in ferrets.
Antiviral Res.2002; 54:99
-111.
PUBMED
16. Ives JA, Carr JA, Mendel DB, et al. The H274Y mutation in the
influenza A/H1N1 neuraminidase active site following oseltamivir phosphate
treatment leave virus severely compromised both in vitro and in vivo.
Antiviral Res.2002; 55:307
-317.
PUBMED
17. Herlocher ML, Truscon R, Elias S, et al. Influenza viruses
resistant to the antiviral drug oseltamivir: transmission studies in ferrets.
J Infect Dis.2004; 190:1627
-1630.
FREE FULL TEXT
18. Mishin VP, Hayden FG, Gubareva LV. Susceptibilities of
antiviral-resistant influenza viruses to novel neuraminidase inhibitors.
Antimicrob Agents Chemother.2005; 49:4515
-4520.
FREE FULL TEXT
19. Hatakeyama S, Sakai-Tagawa Y, Kiso M, et al. Enhanced expression of
an 2,6-linked sialic acid on MDCK cells improves isolation of human influenza
viruses and evaluation of their sensitivity to a neuraminidase inhibitor.
J Clin Microbiol.2005; 43:4139
-4146.
FREE FULL TEXT
20. Gubareva LV, Kaiser L, Matrosovich MN, Soo-Hoo Y, Hayden FG.
Selection of influenza virus mutants in experimentally infected volunteers
treated with oseltamivir. J Infect Dis.2001; 183:523
-531.
FREE FULL TEXT
21. Harper SA, Fukuda K, Uyeki TM, Cox NJ, Bridges CB; Advisory
Committee on Immunization Practices, Centers for Disease Control and
Prevention (CDC). Prevention and control of influenza: recommendations of the
Advisory Committee on Immunization Practices [published correction appears in
MMWR Morb Mortal Wkly Rep. 2 0 0
5; 54:750
].
MMWR Recomm Rep.2005; 54(RR-8):1
-40.
PUBMED
22. Burmeister WP, Ruigrok RW, Cusack S. The 2.2 A resolution crystal
structure of influenza B neuraminidase and its complex with sialic acid.
EMBO J. 1992;11:49
-56.
PUBMED
23. McKimm-Breschkin J, Trivedi T, Hampson A, et al. Neuraminidase
sequence analysis and susceptibilities of influenza virus clinical isolates to
zanamivir and oseltamivir. Antimicrob Agents
Chemother. 2003;47:2264
-2272.
FREE FULL TEXT
24. Moscona A. Neuraminidase inhibitors for influenza. N
Engl J Med. 2005;353:1363
-1373.
PUBMED
25. Monto AS, McKimm-Breschkin JL, Macken C, et al. Detection of
influenza viruses resistant to neuraminidase inhibitors in global surveillance
during the first 3 years of their use. Antimicrob Agents
Chemother. 2006; 50:2395
-2402.
FREE FULL TEXT
26. World Health Organization. Use of influenza antivirals during
2003-2004 and monitoring of neuraminidase inhibitor resistance.
Wkly Epidemiol Rec.2005; 80:156
.
PUBMED
27. Oo C, Hill G, Dorr A, Liu B, Boellner S, Ward P. Pharmacokinetics
of anti-influenza prodrug oseltamivir in children aged 1-5 years.
Eur J Clin Pharmacol.2003; 59:411
-415.
PUBMED
28. Cass LM, Brown J, Pickford M, et al. Pharmaco-scintigraphic
evaluation of lung deposition of inhaled zanamivir in healthy volunteers.
Clin Pharmacokinet.1999; 36(suppl 1):21
-31.
PUBMED
ARTICLE EN RAPPORT
Des nouvelles sur la résistance médicamenteuse du virus influenza de type B qui ne peuvent être ignorées
Anne Moscona et Jennifer McKimm-Breschkin
JAMA. 2007;297:1492-1493.
Texte Complet
|